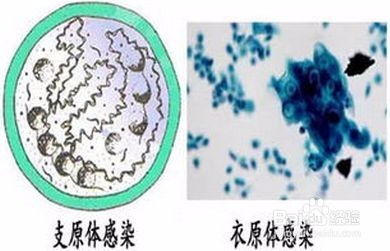
对于一般的细胞建议直接丢弃。因为支原体处理起来确实很麻烦,办法也并不是特别有效。
对于特别珍贵的细胞有一下三种方法:
第一种方法:使用泰乐菌素(tylosin),Sigma,120多块钱
泰乐菌素是一种兽用抗生素,常用在鸡、猪的食料辅料,可以防止支原体感染引起的支气管哮喘,至今尚未见有耐药菌株,是治疗支原体感染的特效药。
第二种方法:M-Plasmocin:
InvivoGen公司研究开发的新一代支原体抗生素M-Plasmocin能有效地杀灭支原体,不影响细胞本身的代谢,并且用M-Plasmocin处理过的培养细胞,不会重新感染支原体。
第三种方法:用BM-Cyclin-1、2,
效果很好支原体感染,但方法如下:
细胞传代同时加BM-Cyclin-1 10μg/ml,37℃培养3天,加入BM-Cyclin-2 5μg/ml,37℃培养3天;(不需传代,因为支原体污染的细胞生长非常慢!)如果细胞生长恢复正常,即可结束。否则加BM-Cyclin-1 20μg/ml,37℃培养3天,加入BM-Cyclin-2 10μg/ml,37℃培养3天。怀疑是支原体污染的就可以试试了,对细胞不会有太大影响。
由于支原体对细胞培养的交叉污染严重并在无意识之中发生,故对支原体检测为阳性的细胞株应丢弃;只对某些贵重的细胞株而言,才设法去除支原体。常用方法有药物法、免疫法、稀释法、加热法等。从感染的细胞系中去除支原体较简单的方法是用阻碍支原体DNA 或RNA 合成的抗支原体类抗生素处理细胞。普遍的抗生素在细胞培养液中对支原体是无效的。而用于去除支原体的药物均为喹诺酮类和/或四环素类抗生素的衍生物。
试剂与仪器
抗支原体药物:四环素与截短侧耳素的复合物(BM-cyclin);卡那霉素、二甲胺四环素与胼胝素协同使用,氟代喹诺酮类抗生素等,已有成品供应。
细胞培养基:25cm2 组织培养瓶
金属通风橱、CO2 孵箱、离心机等
方法与步骤
细胞的去除支原体处理
1. 药物法
(1)支原体污染的细胞以105 个细胞/ml(25cm2 培养瓶中约10ml)接种于常规培养基并加有抗支原体药物,药物浓度为理论(想)值IC50。, 即采用5~10 倍于常用量的冲击法。
(2) 培养48h 后,去除培养液,恢复原先处理,并在1 周内重复同样的处理。
(3) 培养1 周后,将细胞接种于常规培养基内。
(4) 常规培养2 周后,用前法所述检测细胞有无支原体污染,如果无支原体检出,则重复实验。2 至3 周后再次检测以确定该结果,经这样处理的细胞认为是无支原体污染的。
2. 免疫法
要用抗支原体抗体或人及动物血清中的补体与污染细胞株于体外培养。支原体结合并裂解破坏支原体。或用动物接种法将污染支原体的肿瘤细胞接种于同种系动物皮下或腹腔,或接种于裸鼠腹腔,利用动物体内免疫系统杀伤支原体。
3. 克隆法
克隆法即有限稀释法。将污染支原体的细胞进行有限稀释,接种于96 孔培养板,使之每孔只接种一个细胞,进行克隆培养,经前法检测,挑取无支原体污染的细胞克隆支原体感染,这种方法对污染较轻的细胞株效果好。
4. 加热除去
根据支原体对热耐受性较差的特点,将受支原体污染的细胞置于41℃ 中作用5~10h,最长可达18h,以杀灭支原体,但41℃ 对培养细胞本身也有伤害,故在处理前应欲试验摸好条件。另外有人利用软琼脂技术,经50℃ 加热(4~6min)灭活污染细胞的支原体,再于37℃培养1~3 天,使琼脂中抗生素与支原体进一步作用,使热灭活的支原体彻底被清除。
个人觉得药物处理的方法比较好,我使用Invivo 公司的Plasmocin除去支原体成功过……
/uploads/",@me) /}