下面将我的处理前后图片及有无抗支原体药物的时候同时转染的图片发出来,以供参考:
另外,怀疑支原体感染的原因如下:
给出这个结论确实是推测.理由:
1.细胞培养长达一个星期没有变化,不分裂,无法传代
2.加新鲜培养基后几个小时培养基就变黄,但是仍然是清澈的支原体感染,不浑浊
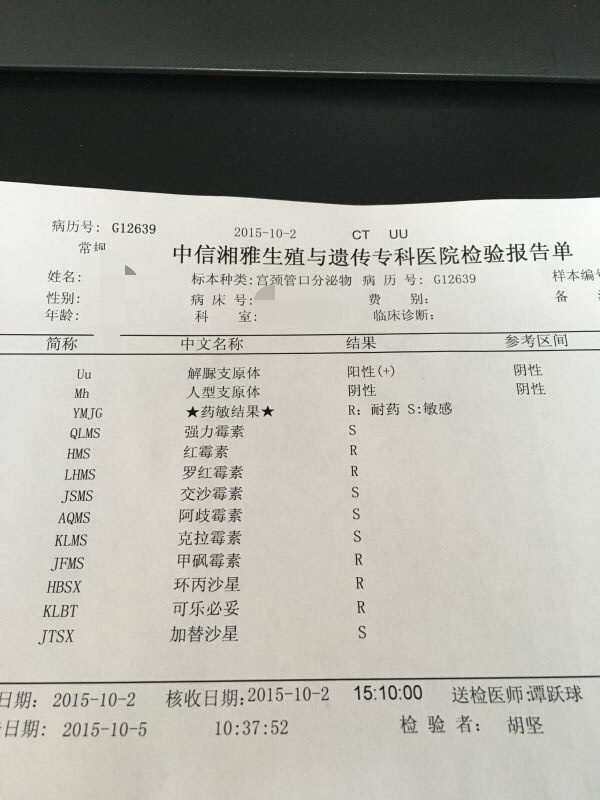
3.细胞转染效率很差支原体感染,转染后状态明显变差,部分死亡,出现细胞间的小颗粒.
4.在光镜下可见到细胞核及胞浆内多发空泡
5.给予抗支原体试剂后上面所有情况都可以逆转
另外,一般而言,支原体感染都不重,不会明显影响细胞生存,当细胞较弱活着转染后,感染加重,细胞出现无法传代,停止生长,大量空泡变化,甚至死亡裂解.
没有说上图中的小黑点是支原体,可能是支原体导致的细胞裂解后的小碎片之类的,就是背景很脏.

同一个六孔板,上面三个空加了抗支原体药物,下面三个没有加,培养两天后观察:
加了药物的可以继续生存,没加抗支原体药物的都死了,裂解了.
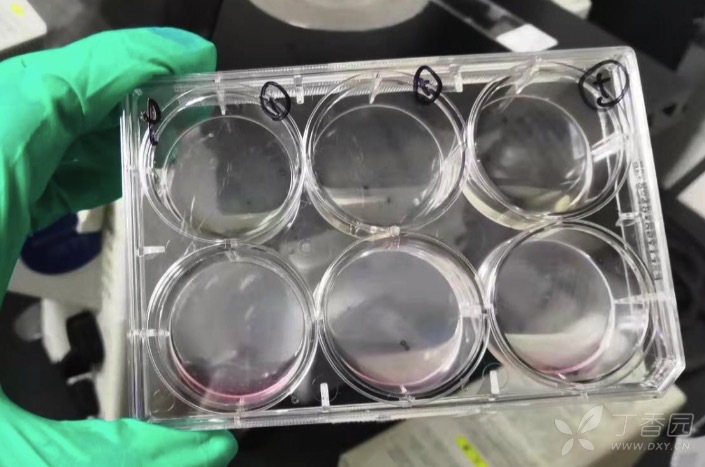
镜下观:
加了抗支原体药物的:

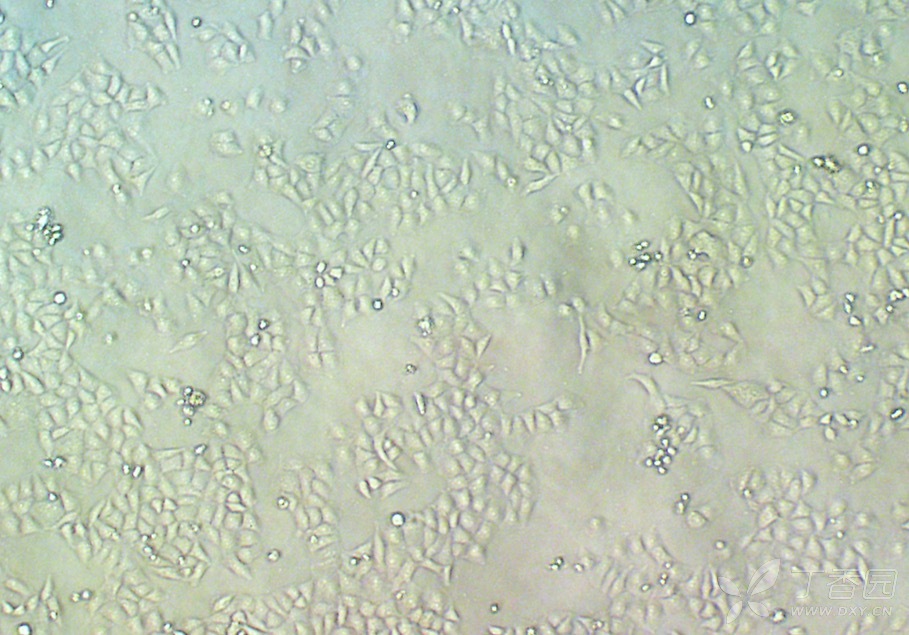
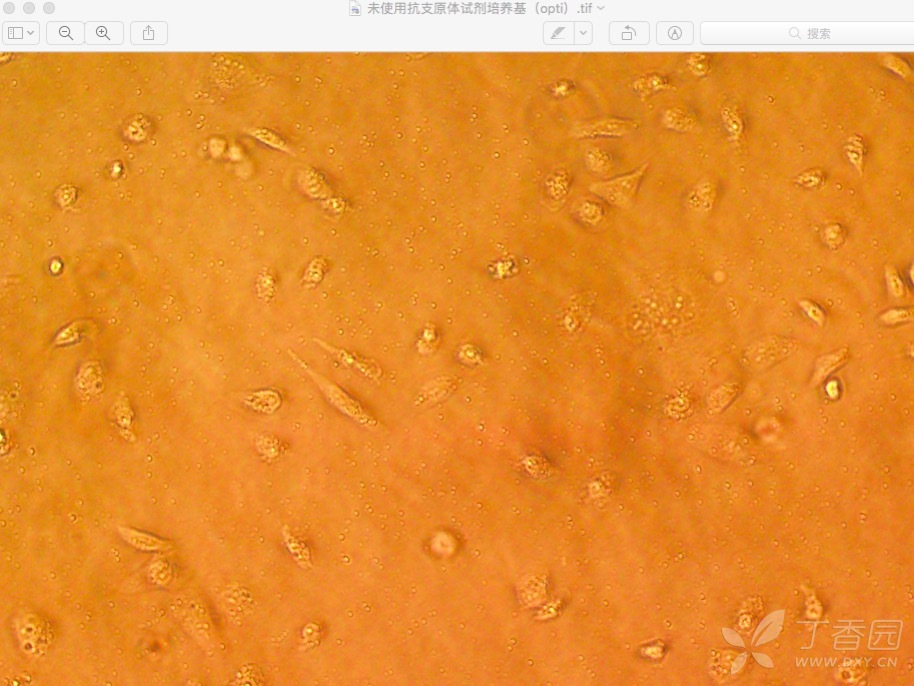
没有加抗支原体药物的:
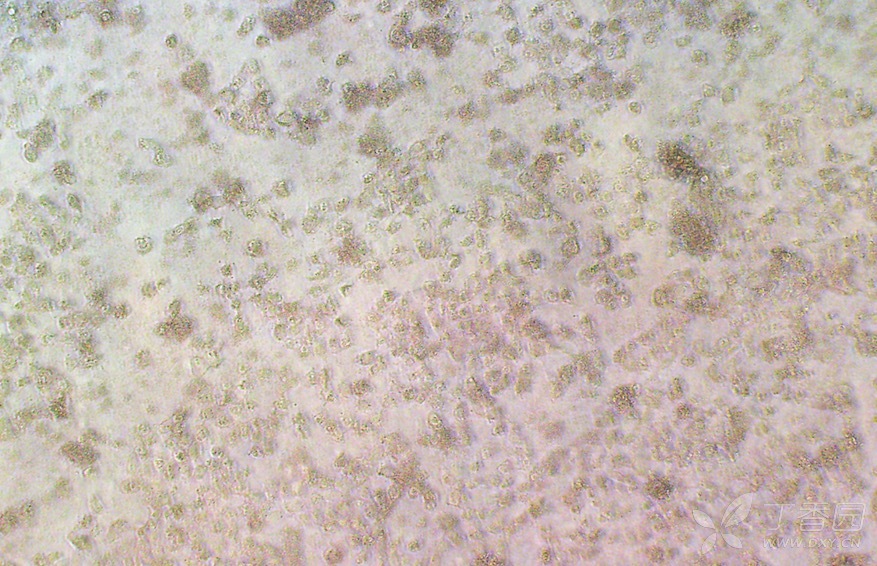
抗支原体药物处理两天后,做转染,一组用有抗支原体药物的培养基,一组用没有抗支原体的培养基,没有的会再次出现黑点,(两天不足以全部杀死支原体,转染是容易复发)
有抗支原体药物的培养基转染:
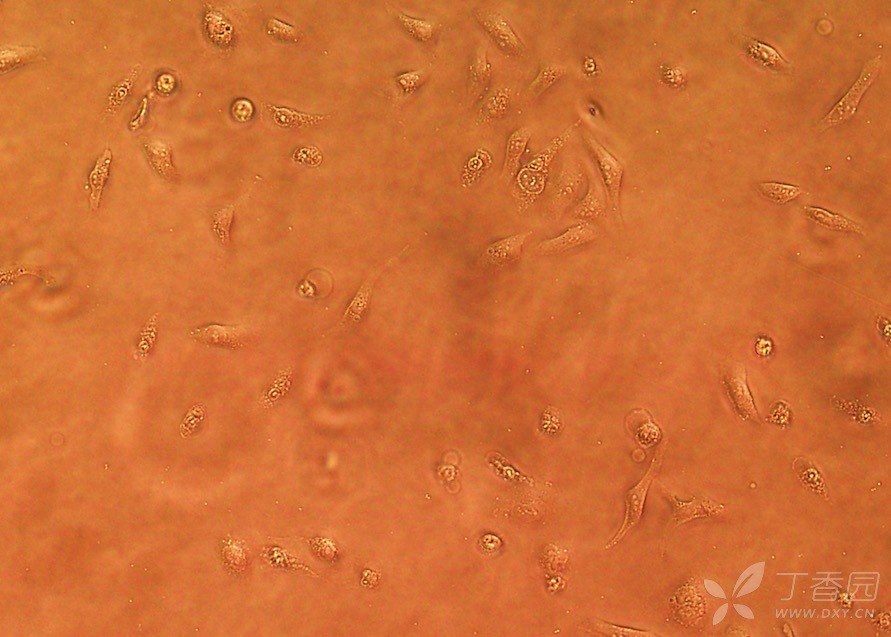
没有抗支原体药物的培养基做转染
以上是部分图片供大家参考.
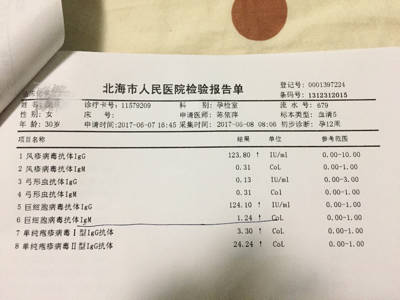
支原体污染很常见,大概在百分之60到80,很容易影响实验,特别是药物处理,转染之类影响细胞状态的操作,有条件有经历的可以做Hoechst 染料染色活着pcr,没有条件的最简单的发现培养液很快变黄,细胞生长变慢,无法传代,背景脏但是培养基不浑浊,可以直接用抗支原体试剂了,或者直接换细胞,祝大家实验顺利吧......
/uploads/",@me) /}