原标题:继全球3个艾滋病“治愈”案例后,第四例HIV“治愈”患者会出现在中国?
《医师报》588期6版曾报道继世界首例艾滋病功能性治愈患者“柏林病人”之后,经治疗后疑似被治愈的“伦敦病人”和“杜塞尔多夫病人”也被报告。三例患者均为感染HIV的血液肿瘤患者,需要接受干细胞移植针对血液肿瘤进行治疗。
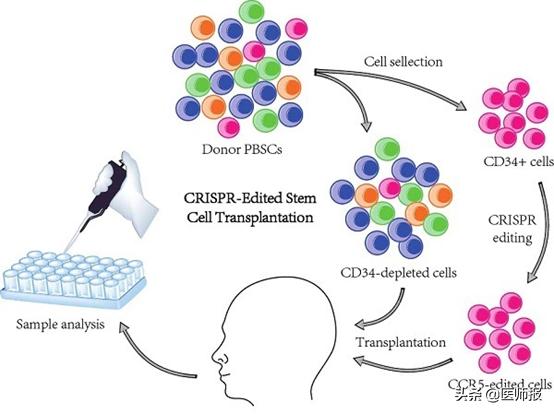
研究者均进行了干细胞移植的供者挑选,供者的干细胞均含有 “CCR5-Δ32”纯合突变基因。CCR5基因被认为是HIV入侵T细胞的主要共受体(邓宏魁教授是主要发现者之一),而CCR5基因呈缺陷型(CCR5-Δ32)的人群不会被R5嗜性HIV病毒感染。那么使用基因编辑技术敲掉移植供者干细胞CCR5基因上第32对碱基,然后给患血液肿瘤的HIV感染患者移植,是否可以实现肿瘤和艾滋病双双治愈?

为了回答这一问题,北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组合作开展此研究。(N Engl J Med.9月11日在线版)
从动物到人
早在2017年邓宏魁研究组就已经利用CRISPR/Cas9构建了经过基因编辑后的人造血干细胞,移植后能在动物模型中长期稳定地重建人的造血系统,其产生的外周血细胞具有抵御HIV感染的能力。此次,研究组经过技术改进、伦理审批后,将该技术应用于2016年5月相继被诊断出患艾滋病和急性淋巴细胞白血病(T细胞型)的27岁男性患者。

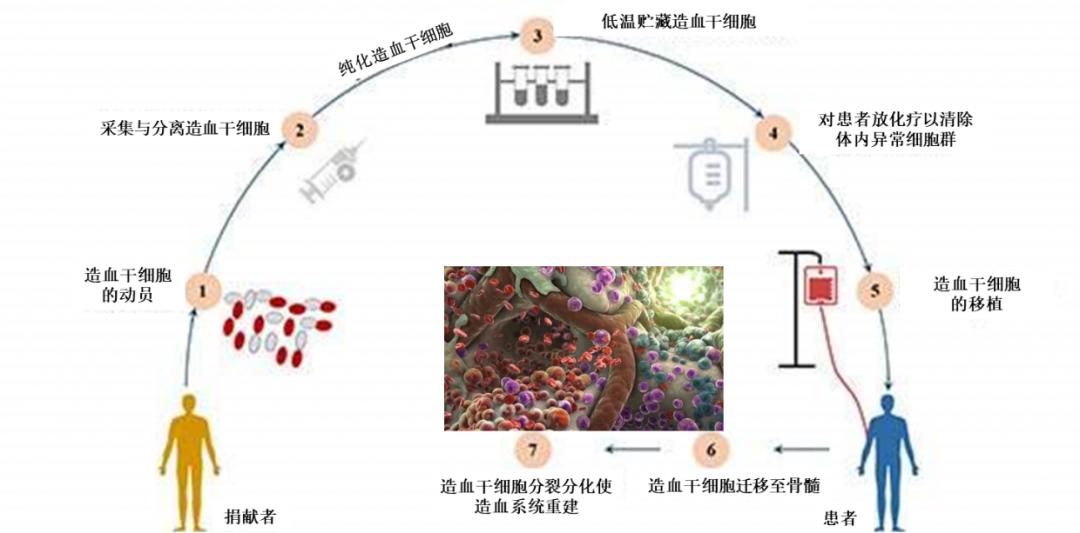
患者在经过抗HIV治疗1年及6个月白血病化疗,血清无法检测HIV RNA、流式细胞仪无法检测微小残留病灶后开始此项治疗。造血干细胞供者是一名CCR5未突变、HLA完全相合的33岁男性。移植流程见下图。
患者干细胞移植流程

五大研究发现
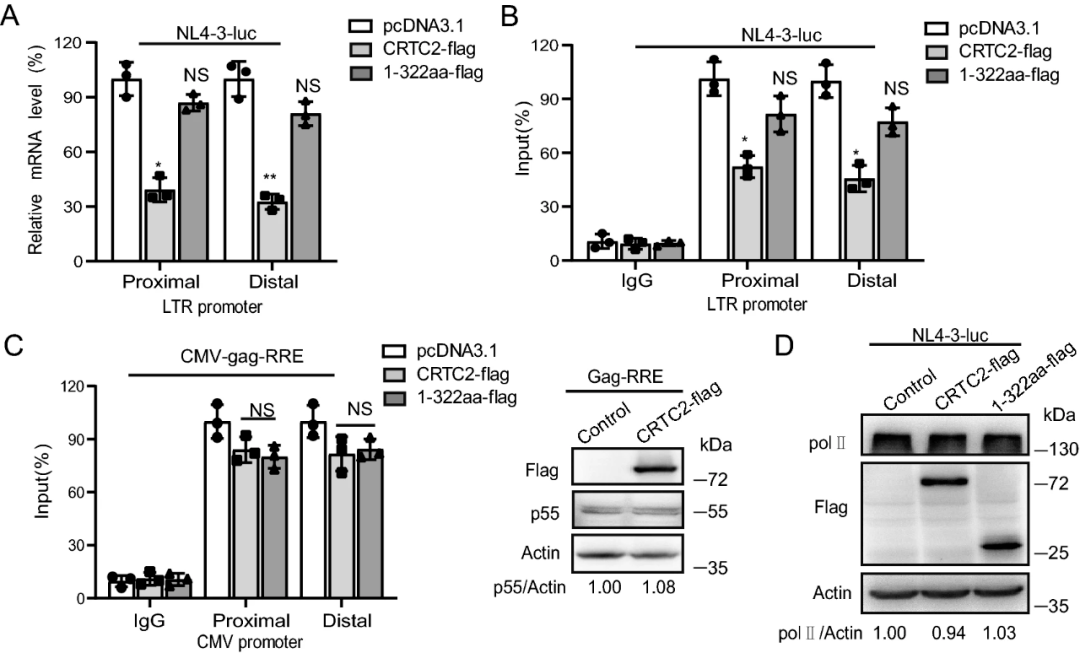
01 在供者来源的CD34﹢细胞上实现了17.8%的CCR5基因敲除效率;
02 移植后4周,患者白血病处于完全缓解状态,供者型骨髓细胞嵌合率达100%;

03 经过长达19个月的随访发现,患者白血病处于持续完全缓解状态,供者型细胞完全嵌合,骨髓细胞中能够持续检测到CCR5基因编辑细胞;
04 19个月的观察中并未发现基因编辑造成的脱靶及其他副作用。这些结果表明,基于CRISPR的成体造血干细胞基因编辑技术能够在患者体内实现长期稳定的基因编辑效果,经过编辑后的成体造血干细胞能够长期重建人的造血系统。
05 为了初步探索治疗的有效性,对该患者短暂停止服用抗HIV病毒药物。在短暂停药期间,虽然表现出一定程度抵御HIV感染的能力,但CD4﹢细胞中HIV-1DNA表达迅速上升艾滋病治愈,CD4﹢细胞数量下降,且出现可测量的病毒载量。这表明基因编辑对CCR5基因敲除的效率不足以支持治愈HIV感染的目标。下一步的目标是提高基因编辑的反应效率。
杂志述评
述评提醒,基因治疗后肿瘤发生的潜伏时间可达31~68个月,在开展后续应用前应对此病例有足够长时间的随访。此外携带CCR5-Δ32纯合突变者较杂合突变或未突变基因携带者寿命短,也是基因治疗的担忧。最后,比较了宾夕法尼亚大学从动物实验到人体试验所需时间是5年,而中国仅需 2年,一方面中国对研究转化的监管环境更宽松,此外,广义上说细胞疗法开展的周期比传统药物研究周期更短。
本文的合作研究者之一,《医师报》血液专栏编委、全军造血干细胞移植中心主任、国家科技进步一等奖获得者、中国科学院院士候选人、解放军总医院第五医学中心教授陈虎,于2019年7月24日因病逝世,享年57岁。我们怀念他。返回搜狐艾滋病治愈,查看更多
/uploads/",@me) /}