关键词:点击次数:
最近看大家常提到支原体污染,就翻了翻书,做了些笔记,现在贴出来和大家分享:
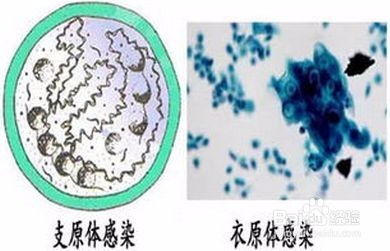
支原体是一种大小介于细菌和病毒之间(最小直径0.2um)并独立生活的微生物。约有1%可通过滤菌器。支原体无细胞壁形态呈高度多形性。可为圆形、丝状或梨形。
支原体形态多变,在光境下不易看清内部结构。电镜下观察支原体膜为三层结构。其中央有电干密度大的密集颗粒群或丝状的中心束。支原体多吸附或散在于细胞表面和细胞之间。横断面与细胞微绒毛相似,但微绒毛电子密度比支原体小,且中央无颗粒群或中央束。
支原体代谢需固醇类物质、部分种类需要精氨酸、O2或葡萄糖,每一种支原体都有自身持点。多数支原体适合于偏碱条件下生存(PH7.6—8.0),对酸耐受性差。对热比较敏感,对一般抗生素不敏感。
支原体污染细胞后。培养液可不发生混浊。多数情况下细胞病理变化轻微或不显著,细微变化也可由于传代、换液而缓解。因此易被忽视。但个别严重者,可致细胞增殖缓慢。甚至从培养器皿脱落。
为确定有无支原体污染可做如下检测:
①相差显微境检测:将细胞按种于事先放置于培养瓶内的盖玻片上,24h后取出,用相差油镜观察。支原体呈暗色微小颗粒位于细胞表面和细胞之间。
②荧光染色法:荧光染色用能与DNA特异性结合的荧光染料Hoechst 33258,可使支原体内含有的DNA着色,染色后用荧光显微镜观察。具体方法如下:首先将细胞接种盖玻片上,在细胞未长满前取出玻片,用不合酚红的Hanks液漂洗一下,用l: 3醋酸甲酵固定10Min,然后用生理盐水漂洗。置于用生理盐水配浓度为50pg/ml的Hoechst 33258中染色10min。染色后用蒸溜水洗1—2min。向细胞面滴加pH5.5磷酸缓冲液数滴,然后置荧光显微镜下观察。镜下支原体为散在于细胞同围或附于细胞膜表面的亮绿色小点。
③电镜检查;用扫描电镜方法简便快速。也可以利用透射电镜。
④DNA分子条文检查或支原体培养等方法:检出率高。但方法较为复杂
支原体是一类缺乏细胞壁的原核细胞型微生物,大小一般在0.3-0.5um之间,呈高度多形性,有球形、杆形、丝状、分枝状等多种形态。它不同于细胞,也不同于病毒。支原体用普通染色法不易着色,用姬姆萨染色很浅,革兰染色为阴性。支原体可在鸡胚绒毛尿囊膜上或细胞培养中生长,营养要求比细菌高。
细胞培养(特别是传代细胞)被支原体污染是个世界性问题。在细胞培养中支原体感染发生率达到63%,支原体感染发生后能改变细胞的DNA,RNA及蛋白表达,又不能通过可视法对其进行检测,而且它对细胞的生长率影响较小,不易引起注意。国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和莱氏无胆甾原体(A.laidlawii),为牛源性。以上是最常见的污染细胞培养的支原体菌群,但能够污染细胞的支原体种类是很多的,国外调查证明支原体感染,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
支原体污染的来源包括工作环境的污染、操作者本身的污染(一些支原体在人体是正常菌群)、培养基的污染、污染支原体的细胞造成的交叉污染、实验器材带来的污染和用来制备细胞的原始组织或器官的污染。
组织细胞培养工作中,主要从以下几个方面来预防支原体的污染:控制环境污染;严格实验操作;细胞培养基和器材要保证无菌;在细胞培养基中加入适量的抗生素。支原体污染细胞后,特别是重要的细胞株,有必要清除支原体,常用方法有抗生素处理、抗血清处理、抗生素加抗血清和补体联合处理。支原体最突出的结构特征是没有细胞壁,一般来讲,对作用于细胞壁生物合成的抗生素,如 -内酰胺类、万古霉素等完全不敏感;对多粘菌素(polymycin)、利福平、磺胺药物普遍耐药。对支原体最有抑制活性及常用于支原体感染治疗的抗生素是四环素类、大环内酯类及一些氟喹诺酮;其他类抗生素如氨基糖苷类、氯霉素对支原体有较小抑制作用,所以常不用来作为支原体感染的化学治疗剂。InvivoGen公司研究开发的新一代支原体抗生素M-Plasmocin能有效地杀灭支原体,不影响细胞本身的代谢,并且用M-Plasmocin处理过的培养细胞,不会重新感染支原体。
红霉素有效,而且不影响细胞生长。网友“smilewf”经验是细胞刚开始被支原体污染,细胞生长极为缓慢,而且状态不好支原体感染,细胞之间及底部总有一些亮晶晶的颗粒状物质,换液后好些,但过2天又会增多,培养液清亮,严重时象一层细沙铺在瓶底。刚开始以为是消化过头引起的细胞的碎片和细胞内的颗粒,后来发现与胰酶消化无关。使用红霉素(就在医院的门诊购买,很便宜)后这种现象明显好转,背景干净,细胞生长很快,状态明显好转,但好像红霉素不能完全根治支原体感染,停药后一段时间可以复发,但如果细胞很重要有没有多余的细胞时可以考虑一试,我用后觉得效果不错。
网友“zllxash”的经验:支原体是细胞培养中最常见的,干扰实验结果的一种污染。但由于不易被察觉,有些污染的细胞仍在继续使用。据查,目前各实验室使用的二倍体细胞和传代细胞中约有11%的细胞受到支原体污染。因此,对支原体污染应严加防范。
用卡那霉素预防支原体污染有效。
检测方法:
1、相差显微镜检测;2、低张处理地衣红染色观察; 3、DNA荧光染色法;4、电镜检测;5、3-H胸腺嘧啶掺入法; 6、聚合酶链反映法; 7、免疫学方法; 8 、支原体的培养。
对于支原体污染的细胞,可以采取补救措施:
1、抗生素排除法:可以用5-10倍于常用量的冲击法,加入高浓度抗生素后作用24-48小时,再换入常规培养液,有时可能有效。推荐用量:庆大霉素 200ug/ml ,四环素10ug/ml ,卡那霉素50ug/ml 。对于支原体污染抗生素应用,预防性应用比污染后使用好。
2、 加温除菌:根据支原体耐热性能差的特点。将受支原体污染的细胞置于41度中作用5-10小时可以杀灭支原体。但由于41度对培养细胞本身也有较大的影响,故处理前,应先进行预试验,确定出最大限度杀伤支原体而对细胞影响较小的处理时间。
支原体菌株来源:M.Arginini ATCC23838 精氨酸支原体,M.FermentaneATCC19989发酵支原体 ,M.SalivariumATCC23064唾液支原体 ,M.HominisATCC23114人型支原体 ,M.OraleATCC23714口腔支原体 ,M.HyorhinisATCC29052猪鼻支原体。其共同引物序列来自16s和23s保守区域,外部引物为F1 5′-ACACCATGGGAGCTGGTAAT-3′,R1 5′-GTTCATCGACTTTCAGACCCAAGGCAT-3′;内部引物为 F2 5′-GTTCTTTGAAAACTGAAT-3′,R2 5′-GCATCCACCAAAAACTCT-3′。
PCR反应体系和条件:10×缓冲液(10mMTris-HCl、500mMKCl、20mMMgCl2、0.01%明胶)、PrimerF1、R1、F2、R2的浓度为2nmol/μL、2.5mMd NTPs、Taq酶、H2O、石蜡油覆盖。反应温度和时间为:94℃/2min预变性、94℃/30s变性、55℃/1min退火、72℃/1min延伸,循环30次后72℃延伸5min。第1次PCR反应取模板10μL,第2次PCR反应以第1次PCR扩增产物为模板取1μL。
一种名为BM-Cyclin的化学试剂,除体外培养癌细胞中支原体污染具体方法:
1、选用抗支原体药物(BM-Cyclin-1、2 ),磷酸缓冲液配制,溶液抽滤除菌,0~4℃保存。
2、细胞处理过程:细胞传代同时加BM-Cyclin-1 10μg/ml,37℃培养3天;胰蛋白酶消化、传代,加入BM-Cyclin-2 5μg/ml,37℃培养3天;继续传代追加BM-Cyclin-2 5μg/ml一次,培养2~4天(如细胞污染严重可重复上述处理过程)弃药液,D-Hank’s液洗2次,胰蛋白酶消化传代,进行常规培养。
3 、在细胞检测或实验前,最好再用常用量的5倍庆大霉素或卡那霉素作短时间处理,每天30~60分钟。
支原体的污染是目前细胞实验室比较普遍存在的问题,用药物来杀灭支原体虽是一种重要措施,毕竟是一种补救方法,而且清除后,支原体仍可重新污染细胞。
因此,重要的还在于预防,如严格选用无支原体污染的牛血清,保持细胞培养间洁净和严格无菌操作等。
网友“arlbor”把从网上和书上看到的一些资料与大家讨论一下吧:
细胞株若受到细菌、真菌、支原体、或是特定病毒等之污染时,会严重的影响实验的结果。而细菌、真菌等之微生物污染时,较易自培养基等的外观变化察觉。但是若受到支原体之污染时,细胞之外观较无明显变化,但是其污染会造成细胞之生长速率缓慢、细胞产生病变之型态改变等等变化。
各国细胞库支原体污染的统计表,如下:
国家受支原体污染(%)报告年度
USA-FDA
15
1993(past 30 years)
USA-ATCC
15-20
1992
Japan-(IFO,RIKEN,JCR
80~30~22
1981 1987-1993 1998
Germany-DSM
36
1990-1994
Argentina
65
1987
Israel
32
1986-1993
China
95
1990
造成支原体高污染率的原因为:
1、支原体size 0.1~0.8 um,无细胞壁,可透过一般过滤膜(0.22-0.45 um)
2、支原体污染时,没有明显的肉眼或一般光学显微镜可观察到的特征变化
3、过去缺乏简单、快速且可靠的检测方式
4、细胞流通间缺乏品管,造成实验室间的相互污染
5、研究或操作人员忽略污染问题
/uploads/",@me) /}