艾滋病疫苗为什么至今还没有出现?
原创:孙彩军科学大院今天
发表于“科学大院”
今天,是第31个世界艾滋病日。
艾滋病防控的局面严峻,想必是大家都知道的事实。不过令人疑惑的是,艾滋病是典型由病毒引起的传染病,而疫苗是人类对抗病毒最伟大的发明,人们通过疫苗,消灭了天花艾滋病病毒,有效控制了小儿麻痹症、乙肝等多种传染性疾病的流行。而传播广泛的艾滋病为什么至今仍未开发出有效疫苗呢?

图片来自:
艾滋病毒虽小,但威胁巨大
艾滋病是“获得性免疫缺陷综合征”的简称,来源于英文缩写AIDS(Acquired Immune Deficiency Syndrome),是感染人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)后引起的一种慢性、进行性的致命性疾病。上世纪80年代初,人们发现了艾滋病,在当时这是一种名副其实的绝症,几乎所有类似症状的患者都快速死于该病毒引起的机会性感染和全身器官衰竭。
艾滋病病毒主要是通过性行为(同性、异性)、血液(如不洁注射史、不洁手术史、不洁输血或献血史等)和母婴传播这三个途径感染人体。
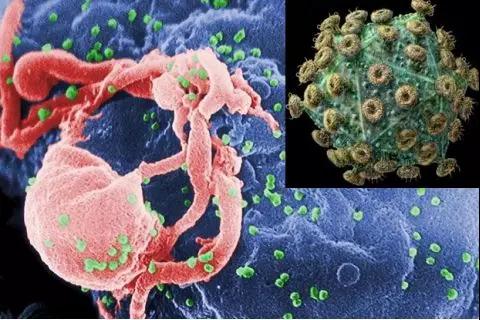
图片来自:百度图片
单纯地从生物学角度看,这个病毒很“小”,基因组只有10kb,仅能编码9个基因,但它造成的危害却很“大”。世界卫生组织(WHO)和联合国艾滋病规划署的最新数据表明:目前全球仍有3690万HIV感染存活者,此外已有约3540万患者死于艾滋病。换句话说,HIV病毒已感染了地球上至少七千多万人,这比第二次世界大战的死亡人数还要多。而且被感染的人数还在以每年约200万的速度在增长(2017年有180万)。
我国的艾滋病流行情况也十分严峻,2018年在昆明召开的第5届全国艾滋病学术会议上的资料表明,我国现有存活的艾滋病感染者至少有82万人,而且快速增长的趋势仍未得到遏制,例如仅在2017年就发现了13.5万新感染者。更令人担忧的是,我国的艾滋疫情已从吸毒、卖血等高危局部人群转变为普通人群的性传播扩散,新发感染者中超过95%经由同性或异性性行为感染。
艾滋病疫苗问世为什么这么难?
人类通过疫苗,消灭了天花,有效控制了小儿麻痹症、乙肝等多种传染性疾病的流行。通过接种疫苗预防传染病是人类在20世纪取得的最伟大公共卫生成就之一,“疫苗接种在降低人类死亡率和促进人口增长方面的重大影响,抗生素也无法匹敌”。

可是人类还没有有效的针对艾滋病毒的疫苗。
人类在1981年第一次发现和报道了艾滋病,很快就在1983年分离到了艾滋病病毒。人们当时很乐观地认为,既然这么快找到了致病元首病原体,然后只要“依葫芦画瓢” 模仿其他病毒疫苗的研发经验就可很快地研制出艾滋病疫苗。
早在1984年,美国卫生部部长就宣称艾滋病疫苗会在两年后问世。又过了十年多后,美国总统克林顿在1997年信心十足地宣布了“艾滋病疫苗的曼哈顿工程”,其重要性可媲美于罗斯福总统在1939年宣布的“原子弹的曼哈顿工程”和肯尼迪总统1961年宣布的“载人登月的曼哈顿工程”。“36年前,肯尼迪总统给出到达月球的目标,我们提前完成了。今天,在生物学时代让我们再设定一个国家新的科学目标:让我们在下一个十年里致力于研发艾滋病疫苗。”
然而,当“原子弹的曼哈顿工程”和“载人登月的曼哈顿工程”相继用了6年和8年的时间顺利成功后,“艾滋病疫苗的曼哈顿工程”在宣布的20多年之后,艾滋疫苗仍旧是梦想,艾滋疫情仍在肆虐全球。
研发有效的艾滋病疫苗已成为最具挑战性的科学难题之一,无数科学家已经和正在为之奋斗终身。尽管从上世纪80年代开始研发艾滋疫苗至今,人类与艾滋病病毒的战绩是0:200!没错,艾滋病病毒已经赢了200多次了,至今仍无成功的疫苗问世。

艾滋病疫苗研发之所以如此困难,原因很多,主要包括:
1、艾滋病病毒有高度的变异性,如同会72般变化那样难觅其踪,传统疫苗研究路径在对付HIV病毒上无法奏效。
2,艾滋病病毒像狗皮膏药一样可整合到宿主细胞的基因组中,因此除非杀死细胞艾滋病病毒,否则无法去除。这给治疗和疫苗研发都带来极大的麻烦。
3,艾滋病病毒只能感染人类,不能感染其他物种并引起发病(少数种类的猩猩,可以被感染但并不发病),因此艾滋病疫苗的研究过程中缺乏良好的动物模型。
4,商业因素,目前的艾滋病药物疗法需要病人终身服药,这给很多药企带来丰厚利润,因此他们不想(嘘,公开场合还是应该说没有太多兴趣)投资于艾滋病疫苗研发。

修改自:Cohen.Science. 2017. Promising AIDS Vaccine’s Failure Leaves Field Reeling
研发艾滋病疫苗的“三大战役”
回顾艾滋病疫苗的研发历史,可以说寻找有效的疫苗就犹如无的放矢和大海捞针,可谓是一波三折,徘徊前行。纵观这大大小小的200余次战斗,尽管一直处于被动挨打的状态,但人类并没有放弃。
艾滋病疫苗的研究可分为三个阶段:诱发体液免疫的疫苗;诱发T细胞免疫的疫苗;同时诱发抗体和细胞免疫的疫苗。我们可以把这些阶段比喻成人类对艾滋病病毒发起的三大战役。经历了这三大战役后,人类虽然暂时还未从万恶的艾滋病病魔中解放出来,但已找到了继续前进和战斗的方向,看到了胜利的曙光。

第一战役阶段
该战役的目的是依据经典疫苗策略诱发出针对艾滋病病毒的中和抗体,起始于1984年的艾滋病疫苗研究集中在以诱导抗体以预防病毒感染为主要目标,没有考虑细胞免疫的作用。2003年在欧美和泰国结束的两个艾滋病疫苗III期临床试验,即实际意义上的艾滋病疫苗第一发展阶段研究成果的临床验证,结果表明单纯诱导抗体产生的疫苗不具真正的保护效果。此次战役仍未结束,仍有很多科学家致力于研发新型免疫策略以诱导出广谱的中和抗体。
第二战役阶段
在诱发抗体策略的多次试验失败后,人类开始反思艾滋病疫苗策略的研发方向,将大部分火力转向于另外一个方向,即强调疫苗能诱发出高效的细胞免疫应答。
该战役阶段以诱导细胞免疫反应的重组病毒载体疫苗为主(痘苗、腺病毒、金丝雀痘病毒等),因为理论上细胞免疫反应可以有效控制病毒的复制与感染,而且数学模型也显示,病毒载量降低1个log值就可以有效降低人群的传播率,这让临床试验看到了这种疫苗的应用前景。
这其中最显著的成果之一就是Merck公司组织开发的以人腺病毒5型为载体的艾滋病疫苗,但2007年9月公布的临床试验结果来看,单纯的强调细胞免疫应答也不能产生保护作用。这次基于T细胞反应疫苗的失败无疑使疫苗研发领域受到了严重的打击,人们曾一度质疑有效的艾滋病疫苗是否能够研制出来,整个领域弥漫着绝望的气氛。
第三战役阶段
在经历了数不清的失败后,科学家们仍没放弃,经过短暂兵力修整后,再次向艾滋病病毒发起了进攻。目前科学家们普遍认为,有效的艾滋病疫苗需要同时诱导出均衡的体液和细胞免疫反应。
在病毒感染时中和抗体作为第一道防线可以中和部分病毒,这给后续的细胞介导的记忆应答争取了激活时间,而强烈的细胞免疫应答清除感染病毒的细胞,降低病毒载量,从而可以降低HIV病毒在人群的传播率。因此这个阶段看重体液和细胞免疫反应的均衡,DNA 疫苗、活载体疫苗、多价蛋白疫苗全面发展,各类疫苗的联合免疫(prime/boost 策略)成为艾滋病疫苗发展的主流方向。
2009年9月公布的美国军方和泰国合作研制的新型联合疫苗(RV144),可使人体感染艾滋病病毒的风险降低31.2%,这是人类历史上第一次在人体中证明研发有效的艾滋病疫苗的可行性,这次试验让我们看到了研发有效艾滋病疫苗的曙光。为了寻找到最终有效的艾滋病疫苗,包括笔者团队在内的科研人员们正在尝试多种不同类型的疫苗联合使用,以期找到最佳组合。

资料来源于IAVI临床实验数据库。
结语
在征服这个前所未有的世纪劲敌——艾滋病的征途中,无数科学家已经正在和将要为之奋斗终生。

高效抗逆转录病毒治疗(即“鸡尾酒疗法”)可有效控制艾滋病情的进展,使得被感染者能有尊严地“如同正常人般”生活,但该疗法仅仅是暂时“控制”着病毒,它无力把体内的病毒彻底消灭。只要停药,那些被压抑着的艾滋病毒就如同被压在五指山下的泼猴被摘掉了“封条咒符”,使出自己的洪荒之力进行反弹,因此一旦被感染,艾滋病患者必须终生服药。
为了彻底控制和消灭艾滋疫情,预防才是最好的办法。预防包括行为干预和疫苗接种。行为干预包括加大健康卫生教育宣传力度;针对吸毒人群,推广美沙酮替代治疗,清洁针具等;避免危险性行为,宣传安全性行为知识,洁身自好;一旦发现感染,尽早就医。在有效的艾滋病疫苗研发成功之前,行为干预是行之有效且必须的预防艾滋手段。
人类更加科学有效地预防艾滋感染的终极目标应是有效的艾滋病疫苗。在研发艾滋疫苗的漫漫征途中,科学家们一直在努力,从未曾放弃。笔者的研究团队长期专注于艾滋病防治新策略的研究,在疫苗设计、免疫治疗、感染机制等方面进行了多项创新工作,探索了一系列新型艾滋病疫苗策略。成功的艾滋病疫苗,人类还要等待多少年?现在还不能给出肯定的数字答案,但我们一直走在攻克它的路上……
参考文献:
1.孙彩军,陈志伟,陈凌,张林琦。特邀综述:创新型艾滋病黏膜疫苗之研究进展。中华微生物学和免疫学杂志。2013, 33(1 ):24-28
2.WuT, Ma F, Ma X, Jia W Pan E,Cheng G, Chen L*,Sun C*. Regulating innate and adaptive immunity for controlling SIV infection by25-hydroxycholesterol.Front. Immunol.,2018.doi: 10.3389/fimmu.2018.02686
3.Pan E, Feng F, Li P , Yang Q, Ma X, Wu C, Yan H, Chen R, Chen L*,Sun C*.Immune protection of SIV challenge by PD-1blockade during vaccination in rhesus monkeys.Front. Immunol., 2018. 9:2415.doi: 10.3389/fimmu.2018.02415
4.XiaoyuWang#,CaijunSun#,PingchaoLi,TongjinWu,HangyuZhou, Dong Yang,YichuLiu,XiuchangMa,ZhiyongSong,QinggongNian,LiqiangFeng,ChengfengQin*, Ling Chen*, andRuikangTang*. Vaccine Engineering with Dual-Functional Mineral Shell: A Promising Strategy to Overcome Pre-existing Immunity.Advanced Materials.2016, 28(4):694-700.
5.CaijunSun,ZhiweiChen, Xian Tang,YinfengZhang,LiqiangFeng,YanhuaDu ,Lijun Xiao, Li Liu,WeijunZhu, Ling Chen,LinqiZhang. Mucosal prime with a replicating vaccinia-based vaccine elicits protective immunity against SIV challenge in rhesus monkeys.JVirol.2013,87; 5669-5677
6.CaijunSUN, Lei ZHANG,MaochaoZHANG,YichuLiu, Miaozhong, Xin Ma, Ling CHEN. Induction of balance and breadth in the immune responses is beneficial to control SIVmac239 replication in rhesus monkey.J Infect.2010, 60(5):371-81.
作者单位:中山大学公共卫生学院(深圳)/ 中国科学院广州生物医药与健康研究
上一篇:刷下存在感,告诉下大家我“未忘初心”——还坚持着艾滋疫苗研究,虽然步履维艰
下一篇:[转载]40篇值得一读的科普文章,39号文章是我的拙作,请多多支持
/uploads/",@me) /}














