HIV病毒库是目前鸡尾酒疗法无法根治艾滋病的主要障碍之一,是携带者不能停药的原因,也是目前国际艾滋病领域研究的热点和难点。
时至今日,国内外对HIV病毒库的形成机制及可能的清除措施进行了大量探索。
艾滋病的功能性治愈是指:病毒并没有被完全清除,但即便不接受抗 HIV治疗,数年内机体免疫功能正常,用常规方法在血液中也检测不到病毒。
鸡尾酒疗法在治疗HIV上已经取得了巨大的成功,阻止艾滋病的发展,使携带者到寿命能不被HIV所影响。但是,目前到治疗手段,患者需要终生服药,终生服药虽然在“四免一关怀“的政策下并不会带来太多到经济负担,但是、药物的不良反应及药物之间的相互作用等,对患者的生活质量及健康带来了较大的影响。检验医学网
HIV病毒库形成的机制
治疗HIV及时病载量测不出不能停药的主要原因就是HIV病毒库的存在。HIV病毒库的半衰期非常长,有报道认为是44个月,也有报道认为更长。HIV病毒库长期处于"休眠"状态。
目前大多数学者认为,HIV病毒库主要以整合的形式存在于静止的记忆CD4+ T淋巴细胞(简称CD4细胞)中,少量存在于幼稚CD4细胞中。对于骨髓细胞是否是HIV潜伏的靶标目前仍存在争议。有多种机制导致了HIV的潜伏,已确定的 HIV潜伏及维持的机制主要包括:
(1)HIVDNA整合位点影响转录水平;
(2)表观遗传的一些特征导致转录沉默;
(3)细胞转录因子的缺乏;
(4)病毒转录的不完全;
(5)转录在细胞核内滞留;
(6)一些MiRNA对病毒蛋白翻译的限制等。
检验医学网
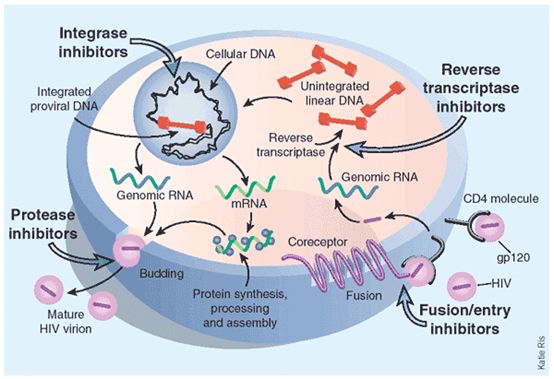
HIV的潜伏

HIV的潜伏是被多种转录限制因素所控制的,并且具体是哪种因素在其中起作用也无法具体说明。目前对于潜伏HIV的形成时间尚无定论,有些报道认为感染48小时内即可潜伏艾滋病治愈,另有报道认为感染7天内形成潜伏。
研究发现,即使在长期用药的情况下,潜伏库也会不断更新。为什么这么低水平的病毒复制也可形成HIV的潜伏,仍是未解之谜。
对于清除潜伏 HIV的目前的研究方向主要是基于病毒库这个理论,即激活潜伏的HIV,然后再通过药物杀灭病毒的治疗策略。研究表明艾滋病治愈,包括组蛋白去乙酰酶抑制剂(HDACis)在内的一些激活剂可成功诱导潜伏HIV的激活,然而,虽然能够激活潜伏HIV,并且激活的同时就使用了抗病毒药物,但这些"激活再杀死"的措施并没有解决潜伏的HIV。
目前仍然不能确定"激活再杀死"措施清除潜伏HIV的失败的具体原因,可能是由于激活不充分也可能是激活的病毒没有被清除所致。

如今目前对HIV潜伏机制的研究其实还是远远不够。HlV-1病毒库与免疫应答HIV感染导致长期的免疫系统紊乱
如果不经过治疗,HIV会对大多数患者免疫系统造成不可逆损害。及时有效的治疗能够部分纠正免疫异常,但持续的炎症及免疫紊乱状态仍可能长期存在。即使在长期治疗之后,HIV感染者的机体免疫系统仍会表现为出慢性低水平炎症反应。
HIV潜伏的免疫细胞
经过长期治疗后,HIV主要以潜伏形式存在于记忆CD4细胞中。最近的研究表明,滤泡辅助性 T细胞(Tfh)有可能是 HIV潜伏的重要靶标。目前还不能完全确定HIV潜伏的CD4细胞亚群,HIV是否潜伏在抗原递呈细胞中,潜伏HIV是否在所有 CD4细胞亚群中都存在,包括 T 调节细胞(Treg),TH1、TH2、TH17和TFH细胞。
这些都还需要进一步研究。
HIV潜伏的组织
研究发现,HIV潜伏的组织主要为一些药物不易进入的组织,如脾、脑、生殖道和胸腺等。但是一些药物能够进入的组织,由于组织致密等原因也是HIV潜伏的重要场所,如淋巴结及内脏等。
寻找HIV功能性治愈的免疫措施
大多数针对潜伏HIV治愈的免疫策略,是寻求通过提高或增加T细胞、抗体、NK细胞或巨噬细胞的功能来进行的。目前有报道指出,HIV特异的细胞毒性T细胞(CTL)具有清除潜伏HIV的作用。通过提高HIV特异的CTL功能来清除潜伏HIV仍然是免疫策略中优先考虑的措施。广谱中和抗体对清除潜伏HIV可起到一定作用。研发能够激活潜伏HIV同时能够识别和消灭产毒细胞的双向抗体,以期消灭潜伏HIV的治疗方式正在进行临床前实验。另有一些科学家研制通过针对T细胞稳态的免疫疗法,旨在反转慢性炎症,以期达到功能性治愈目的的一些措施。包括:
(1)减少T细胞增殖;
(2)减少病毒增殖及新的靶细胞产生,进而减少HIV潜伏细胞的产生;
(3)对一些因子的阻断或增强一些因子的作用。其中的一些方法最近已经在非人类灵长类动物模型中证实是有效的。
最近研究表明,通过对HIV感染急性期进行治疗并在随后停止治疗,可使得一些个体进入长期病毒载量无法检出行列。所以,即使高危后超过了72小时,仍然建议有条件的可以使用阻断措施。检验医学网

细胞治疗与功能性治愈
由于众所周知的全球第一个HIV临床治愈的"柏林病人",该病人接受了CCR5缺陷型干细胞移植后,停药数年后,其外周血、淋巴组织及其他所有组织中的HIV DNA及RNA,均检测不到。
此病人体内也几乎不存在针对HIV的免疫反应,柏林病人是目前唯一的一位HIV临床治愈的病人。由于这例病人的治愈,激起了研究者们期望通过改造干细胞使其CCR5功能缺陷达到功能性治愈目的的兴趣。目前探讨的针对艾滋病功能性治愈的细胞疗法主要有以下几种:骨髓干细胞移植治疗
一直以来,到底是什么导致了该"柏林病人"达到功能性治愈存在激烈的争论。是强烈的预处理方案,包括全身放疗、免疫抑制环孢素A及CD3+T细胞耗竭消除了HIV潜伏库,又或者是移植了CCR5-/- 的干细胞,类似的结果在野生型的同种异体干细胞移植过程中是否能够重复,后面的这种可能性得到了证实。
有报道两例CCR5Δ32杂合子病人("波士顿病人"),移植了野生型的干细胞后,在病人的外周血中持续检测不到 HIVDNA及HIVRNA。虽然病人移植后也进行了治疗,但后来病人停药后病毒反弹时间已大幅推迟。
基因工程修饰的干细胞治疗
迄今为止大多数的HIV基因治疗都基于病人自身(同源)细胞的基因工程修饰,来获得HIV抵抗性,或通过移除CCR5或引入能够编码抗HIV蛋白的基因来实现对HIV的清除。间充质干细胞治疗
间充质干细胞具有明显的恢复免疫细胞、胸腺功能及消除炎症反应的作用,是否 MSC具有降低潜伏HIV的作用值得进一步研究。细胞治疗存在的挑战
到目前为止,干细胞移植在治愈HIV中的应用还都有一些局限性,同种异体干细胞移植需要配型,并且仅限于用于合并血液系统肿瘤患者;自体基因修饰干细胞移植存在基因改造效率低、植入存活时间短等问题。
对于HIV感染病人干细胞移植的安全性问题,世界范围内针对CD4细胞或干细胞进行CCR5基因改造回输的临床试验,只有少数报道有轻微的并发症,并且能够看到病毒的降低及免疫的恢复。但关于此类治疗方法的长期影响及安全性还需要更多的随访观察。与野生型干细胞移植相比,改造的CCR5干细胞移植在抗病毒及免疫恢复上没有表现出明显的优势,而且基因修饰细胞的比例只占机体细胞总量的少数。
艾滋病治愈之路
能使多数HIV感染病人真正达到功能性治愈还需要一些时间,功能性治愈仍面临很多挑战。
通过以下环节期望能够逐步达到功能性治愈的目的。
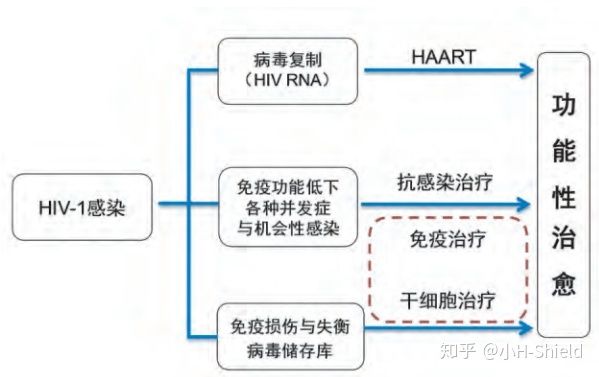
但是目前对于HIV病毒库,尚无有效的清除措施,这就是目前实现HIV治愈的难点所在。
我们距离HIV的治愈,目前还差一个病毒库。
/uploads/",@me) /}