创下多个“第一”记录的Trogarzo(Ibalizumab)于今年3月7日获FDA正式批准,用于既往尝试过多种HIV药物治疗且对多种抗病毒药有耐药性的成人患者。
Trogarzo的多个“第一”记录包括:是近十年来第一个具有全新作用机制的抗艾滋病毒药物,也是第一个HIV长效新药,是第一个FDA批准用于治疗艾滋病的单抗产品,也是第一个在中国生产、并得到FDA批准进入美国市场进行销售的无菌生物制剂。
近日,《医药经济报》记者有幸采访了美国纽约洛克菲勒大学艾伦·戴蒙德艾滋病研究中心主任何大一博士以及药明生物专家,了解到Trogarzo获批背后的故事。

美国纽约洛克菲勒大学艾伦·戴蒙德艾滋病研究中心主任 何大一博士
在二十多年开发历程中艾滋病治愈,Ibalizumab曾先后辗转于百健、Tanox、基因泰克、中裕新药4家企业,有波折也有顺遂。与之相伴的是,艾滋病治疗药物研发趋势也发生了改变,“治愈”的愿景正随着相应领域抗体研究热度的提升而变得不再遥不可及。

全新疗法诞生“天时地利人和”:
“执着的何大一”+“抗体药高速发展期”+“药明生物CDMO”
作为全球最早发现并认识到艾滋病是由病毒引起的科学家之一,何大一博士从事艾滋病领域研究已三十余年。他开创了三种或三种以上的抗病毒药物联合的高效抗逆转录病毒治疗(俗称“鸡尾酒疗法”),使得艾滋病从“致死”转变为“可控”。
在上世纪90年代取得一系列耀眼成就后,何大一博士开始致力于研究预防HIV感染的疫苗,试图彻底攻克艾滋病。但是,HIV病毒变异非常复杂,HIV疫苗无法实现让免疫系统快速建立持续的免疫能力。三十多年过去,该领域一直没有取得突破性的科学进展。
“在可预见的未来,我还看不到HIV疫苗成功的希望。不过,如果寻找一种代替其发挥预防作用的有效手段,最有前景的就是抗体。”何大一博士告诉《医药经济报》记者,根据现有研究显示,抗体不仅有望预防HIV感染,还可以兼具治疗作用。最近十年,他也把主要精力转向了防治艾滋病的新一代抗体开发上。

上世纪90年代后期,随着人源化抗体技术进步,抗体药物进入快速发展时期,利用抗体治疗各类疾病的研究不断涌现。彼时,口服鸡尾酒疗法表现出色,开发治疗艾滋病的抗体药物并未引起业界足够关注。
1997年,对艾滋病领域十分感兴趣的Tanox从百健(Biogen)获得了HIV长效单抗药物TNX-355(即Ibalizumab)的授权,TNX-355与CD4+T细胞受体的第二个胞外区域结合,可以防止艾滋病毒感染CD4+免疫细胞,同时保持正常的免疫功能。
然而,在2007年Tanox被基因泰克收购后,Ibalizumab却并不为后者重视。一方面,Ibalizumab不符合基因泰克当时以癌症为主的产品线布局;另一方面,基因泰克对Ibalizumab评估后认为研发成本过高,继续开发下去代价较大。
后来,由何大一博士参与创办的中裕新药(原名宇昌生技)与基因泰克签署独家授权协议,引进了Ibalizumab,并进一步开发。
在落户中裕新药长达五六年的时间里,Ibalizumab的开发进展较为缓慢。尽管中裕新药作为一家小型研发企业在病毒感染疾病领域更加专注,但独自推进产品上市仍然面临很多挑战:其一,Ibalizumab几经转手遗失了很多技术资料,而熟悉其开发的Tanox员工已经散布到全球各大医药企业;其二,公司仅有6个员工,如何在有限的资金支持下高效地推进产品上市?其三,Ibalizumab适应人群有限,市场规模较小,公司管理层反复思考是否有必要针对该产品建立生产基地。
得益于CDMO产业的迅速崛起,中裕新药开始为Ibalizumab的开发和生产四处寻找合适的合作伙伴,但很多老牌CDMO企业却不愿为这样一个几乎需要从头摸索工艺的新药项目投入人力和物力。
彼时,药明生物还是药明康德集团旗下的子部门之一,业务刚刚起步,位于无锡的生物制药研发生产基地仍在建设中,而中裕新药作为研发型初创企业也未有上市销售的产品,中国制造的高端生物制剂获批进入发达市场还没有先例。“我们抱着对彼此的信心于2012年达成了合作,共同为Ibalizumab获得美国FDA批准上市的目标而努力。”药明生物首席执行官陈智胜坦言。
巧合的是,药明生物非执行董事胡正国以及药明生物副总裁李锦才博士都曾就职于Tanox,后者还进入基因泰克工作了一段时间,在Tanox和基因泰克均参与过Ibalizumab研发。凭借这段“姻缘”,药明生物在收集到的Ibalizumab原始开发资料上不断探索,重新建立了针对药明生物平台的工艺流程。六年后,Ibalizumab作为中裕新药的第一个产品成功获批进入美国市场。
展望新方向,“治愈”非天方夜谭:
高质量开发平台,多种抗体组合,传染性感染性疾病抗体研发热
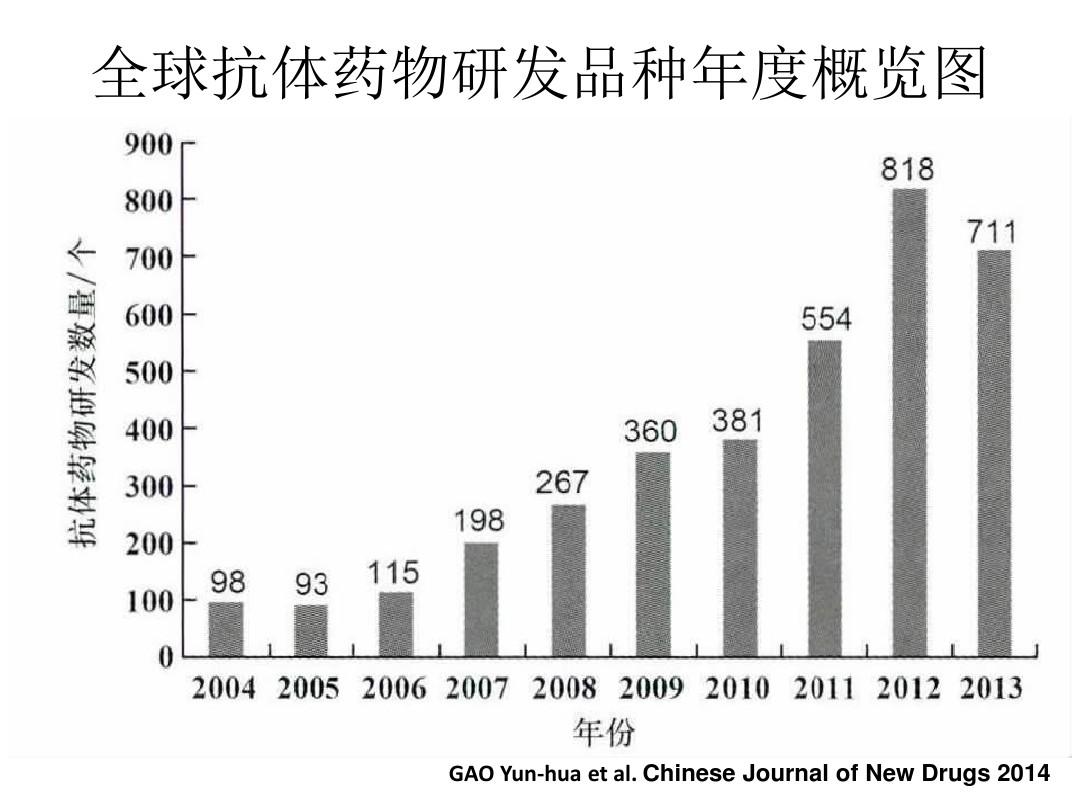
众所周知,生物药开发与生产的难度非常大艾滋病治愈,而在中国市场开发和生产获得美国FDA认可的生物药难度更大。
以单抗药物为例,单抗药物生产涉及上万亿的活细胞,这对工艺控制、质量管理等诸多方面提出挑战。过去,我国药品生产企业在质量体系、人员素质等方面与欧美国家存在很大差异,部分亚洲原料药企业和制剂企业由于数据完整性问题曾被FDA警告,国外药品监管机构在审查时往往对中国企业戴着“有色眼镜”。而改变这一偏见需要付出巨大努力。
通常情况下,FDA针对普通化药批准前的检查,一般是派出2~3个检查员检查几天时间。当时针对Ibalizumab的批准前检查,FDA共派出5名检查员对药明生物无锡cGMP生产基地展开了为期13天的检查,检查的时间久、内容细。
谈及FDA检查的严苛程度,全程参与PLI检查的药明生物副总裁董健举了一个例子,“FDA检查员在资料中发现某员工某一天登记了取水样的试验记录,为了核实数据真实性,他会调取相应时间的监控录像以及该员工刷卡出入记录进行对比。”
据董健介绍,药明生物自2016年开始从质量体系、工艺、员工培训等各个方面准备Ibalizumab的PLI检查,对照FDA近年发出的所有警告信中的缺陷项加以改进完善,在内部多轮审计的基础上又聘请了经验丰富的外部专家提供建议。尽管在实际PLI检查过程中发现存在少量一般缺陷,但公司都如实地回答了FDA检查员疑问并及时提出了整改方案,最终顺利完成了Ibalizumab的PLI检查,成为目前中国唯一通过美国FDA GMP认证的生物制药公司。
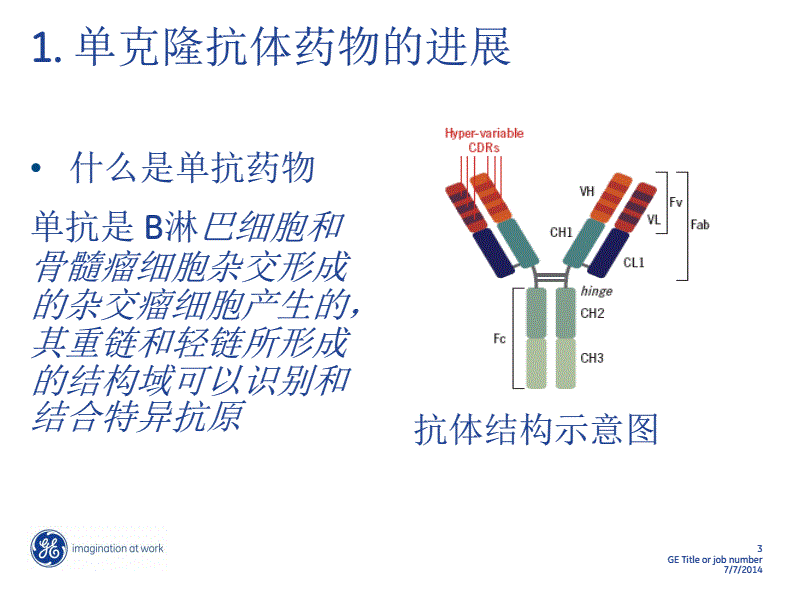
据悉,由何大一博士主导研发的第二代Ibalizumab(肌肉注射剂型)和10E8/imAb双特异性抗体目前已授权给中裕新药进一步开发,未来也将继续依托药明生物开放式生物制剂技术平台加快上市进程,其中10E8/imAb双特异性抗体预计于今年下半年进入人体临床试验。
“由于HIV病毒拥有极强的变异能力,患者长期接受单一抗体治疗同样会产生耐药性。未来如果希望抗体更好地发挥治疗作用,则需要用多种抗体组合。”据何大一博士介绍,目前其所在的团队开发的下一代抗体针对HIV病毒抗药性进行了改造。
何大一博士认为,开发艾滋病治疗药物的长远目标是注射两种或两种以上抗体,每月甚至数月一次间隔给药,从而取代每天口服小分子药物。
小分子药物目前只能控制或者阻挡病毒延缓感染性疾病发作,而抗体可以通过杀死病毒或者引起感染的微生物实现治愈感染性疾病的愿景。何大一博士表示,“我相信在迈向治愈艾滋病的道路上,抗体将扮演非常重要的角色,未来也将有越来越多防治艾滋病的抗体获批上市。”
相比于二十年前,应用抗体防治HIV感染的研究已变得越来越广泛。《医药经济报》记者近日在Clinicaltrials.gov上检索时发现,全球范围内治疗HIV感染的单抗临床试验数量达到85个。目前在HIV治疗领域领先的药企如吉利德、GSK也已开始针对这一领域布局双特异性抗体技术平台。
如今,不仅是HIV病毒,细菌毒素、寨卡病毒等引起的传染性感染性疾病也成为抗体研究的热点,不少相关基础研究以及临床研究正在如火如荼地展开。也有观点认为,传染性感染性疾病是继肿瘤后的下一波抗体热潮所在。
延伸
/uploads/",@me) /}