HIV 病毒摘要:HIV 全称 Human Immunodeficiency Virus,即人类免疫缺陷病毒,是造成人类免疫系 统的缺陷的一种病毒。该病毒破坏人体的免疫能力,导致免疫系统失去抵抗力,从而导致从 而导致各种疾病及癌症得以在人体内生存, 发展到最后, 导致艾滋病—获得性免疫缺陷综合 征。本文概述了目前研究的 HIV 病毒特点及研究进展。 关键词:HIV 病毒 特点 研究进展 1 前言 研究认为,艾滋病起源于非洲,后由移民带入美国。艾滋病最早是于 20 世纪 80 年代初 期在美国被识别,早期的病人都是年轻的男同性恋者,因此艾滋病一度被称作“同性恋病” ("gay plague"或"gay-related immune deficiency"(GRID) ) ,并受到当时里根保守政府 的忽视。 但在美国疾病控制与预防中心以及有识的医生与科学家的持续工作下, 累积了信服 性的流行病学数据,显示艾滋病有一定的传染性致因(etiology) ,同时,因输血导致非同 性恋者罹患艾滋病的病例逐渐增多, 许多科学家开始调查此传染性病原。 1981 年 6 月 5 日, 美国疾病预防控制中心在《发病率与死亡率周刊》上登载了 5 例艾滋病病人的病例报告,这 是世界上第一次有关艾滋病的正式记载。
1982 年,这种疾病被命名为“艾滋病”。不久以 后,艾滋病迅速蔓延到各大洲。1985 年,一位到中国旅游的外籍人士患病入住北京协和医 院后很快死亡,后被证实死于艾滋病,这是我国第一次发现艾滋病病例。HIV 病毒是一种感 染人类免疫系统细胞的慢病毒(Lentivirus) ,属逆转录病毒的一种。至今无有效疗法的致 命性传染病。 早在 1983 年,在巴黎巴斯德研究所专门研究逆转录病毒与癌症关系的法国病毒学家吕 克·蒙塔尼(Luc Montagnier)及其研究组首次从一位罹患晚期卡波西氏肉瘤的年轻男同性 恋艾滋病人(首字缩写 LAI)的血液及淋巴结样品中,分离到一种的新的逆转录病毒;他们 发现这种病毒不同于人类 T4 淋巴细胞白血病病毒(Human T cell Leukemia Virus, HTLV) , 而是一种慢病毒(Lentivirus) ,他们将之命名为“免疫缺陷相关病毒” (Immune Deficiency-Associated Virus, IDAV) 。大西洋另一边,蒙塔尼埃当时的合作者,美国国家 癌症研究所的美国生物医学科学家罗伯特·加罗(Robert Gallo)及属下也从一些细胞株系 中分离到新病毒,并将之命名为“IIIB/H9 型人类 T4 淋巴细胞白血病病毒” (Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9) ;加罗小组首次于 1984 年在《科学》期刊发表论 文,论证了这种新病毒与艾滋病的病原关系。
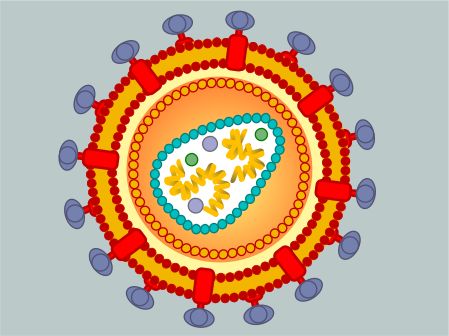
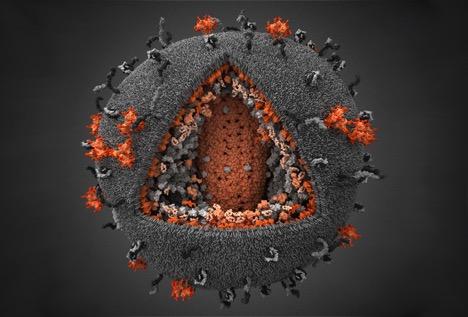
1986 年 7 月 25 日,世界卫生组织(WHO)发 布公报,国际病毒分类委员会会议决定,将艾滋病病毒改称为人类免疫缺陷病毒(HumanImmunodeficiency Virus) ,简称 HIV。 2 HIV 病毒特点 2.1 形态结构 HIV 病毒直径约 120 纳米,大致呈球形。病毒外膜是类脂包膜,来自宿主细胞,并嵌有 病毒的蛋白 gp120 与 gp41;gp41 是跨膜蛋白,gp120 位于表面,并与 gp41 通过非共价作用 结合。 向内是由蛋白 p17 形成的球形基质 (Matrix) , 以及蛋白 p24 形成的半锥形衣壳 (Capsid) , 衣壳在电镜下呈高电子密度。衣壳内含有病毒的 RNA 基因组、酶(逆转录酶、整合酶、蛋白 酶)以及其他来自宿主细胞的成分(如 tRNAlys3,作为逆转录的引物) 。如图 1 HIV 模型图图 1 HIV 模型图2.2 基因编码 病毒基因组是两条相同的正链 RNA,每条 RNA 长约 9.2-9.8kb。两端是长末端重复序列 (long terminal repeats, LTR) ,含顺式调控序列,控制前病毒的表达。已证明在 LTR 有 启动子和增强子并含负调控区。
LTR 之间的序列编码了至少 9 个蛋白,可分为三类:结构蛋 白、调控蛋白、辅助蛋白。 (1) gag 基因能编码约 500 个氨基酸组成的聚合前体蛋白, 经蛋白酶水解形成 P17, P24 核蛋白,使 RNA 不受外界核酸酶破坏。 (2)Pol 基因编码聚合酶前体蛋白,经切割形成蛋白酶、整合酶、逆转录酶、核糖核 酸酶 H,均为病毒增殖所必需。 (3) env 基因编码约 863 个氨基酸的前体蛋白并糖基化成 gp160, gp120 和 gp41。 gp120 含有中和抗原决定簇,已证明 HIV 中和抗原表位,在 gp120 V3 环上,V3 环区是囊膜蛋白的 重要功能区,在病毒与细胞融合中起重要作用。gp120 与跨膜蛋白 gp41 以非共价键相连。gp41 与靶细胞融合,促使病毒进入细胞内。实验表明 gp41 亦有较强抗原性,能诱导产生抗 体反应。 (4)TaT 基因编码蛋白可与 LTR 结合,以增加病毒所有基因转录率,也能在转录后促 进病毒 mRNA 的翻译。 (5)Rev 基因产物是一种顺式激活因子,能对 env 和 gag 中顺式作用抑制序列 (Cis-Acting repression sequance,Crs) 去抑制作用,增强 gag 和 env 基因的表达,以 合成相应的病毒结构蛋白。
(6)Nef 基因编码蛋白 P27 对 HIV 基因的表达有负调控作用,以推迟病毒复制。该蛋 白作用于 HIV cDNA 的 LTR,抑制整合的病毒转录。可能是 HIV 在体内维持持续感集体所必 需。 (7)Vif 基因对 HIV 并非必不可少,但可能影响游离 HIV 感染性、病毒体的产生和体 内传播。 (8)VPU 基因为 HIV-1 所特有,对 HIV 的有效复制及病毒体的装配与成熟不可少。 (9)Vpr 基因编码蛋白是一种弱的转录激活物,在体内繁殖周期中起一定作用。 HIV-2 基因结构与 HIV-1 有差别:它不含 VPU 基因,但有一功能不明 VPX 基因。核酸杂 交法检查 HIV-1 与 HIV-2 的核苷酸序列,仅 40%相同。env 基因表达产物激发机体产生的抗 体无交叉反应。如图 2 HIV 病毒基因编码图3 对 HIV 的治疗 3.1 经典疗法自 20 世纪 80 年代艾滋病被发现以来, 尽管世界各国不惜投入大量的人力物力, 先后研 制了十几种疫苗和近百种药物, 但迄今尚未发现一种治疗艾滋病的特效药。 作为治疗艾滋病 的新武器,华裔科学家何大一教授所提出了“鸡尾酒”疗法一经公布就立即轰动了整个医学 界,各地媒体竞相报导,世界各国的科学家也给予了它很高的评价。
“鸡尾酒”疗法应用于 临床后, 果然有 70%—80%的病人体内病毒随着治疗下降,一时间全世界为之欢欣鼓舞。 1996 年hiv病毒,何大一因此被美国《时代》周刊评选为本年度风云人物;2001 年 1 月美国时任总统克 林顿向他颁发了“总统国民勋章” 。 何大一教授将他的这种治疗方法形象地命名为“鸡尾酒”疗法与此也有相似的含意:就 是同时使用 3—4 种药物,每一种药物针对艾滋病毒繁殖周期中的不同环节,从而达到抑制 或杀灭艾滋病毒,治愈艾滋病的目的。自 1995 年 “鸡尾酒”疗法应用于临床后,已经有很 多患者受益。 它可以控制病人体内的艾滋病毒, 使得病人的免疫系统有机会修复, 恢复功能, 但是艾滋病毒并非一成不变, 在传播和繁殖的过程中它常常发生一些结构和功能的变化, 这 时即使使用原先可能很有效的药,此时也不管用了,导致病毒可以继续在体内大量繁殖,更 不能彻底清除体内病毒、治愈疾病。图 3 艾滋病国际符号图 3 艾滋病国际符号 3.2 最新研究成果 3.2.1 疫苗的研制 2009 年 9 月hiv病毒,在泰国进行的一项由美国军方支持的医疗试验发现,某实验性疫苗能将 感染艾滋病毒的风险大大降低。
人类首次获得了具有一定免疫效果的艾滋病疫苗。 2014 年 3 月,报道称南非国立传染病研究所(NICD)表示,科学家找出能杀死不同艾滋 病毒(HIV)株的抗体,有望研发出艾滋病疫苗。 NICD 病毒学部主任莫里斯说,科学家从一名妇女的血液样本,研究她对 HIV 感染的反应,并且分离出她所产生的抗体。 人体对 HIV 的反应是产生抗体对抗病毒, 在多数情况下抗体无法中和或杀死不同病毒株, 但少数广谱中和性抗体能穿过 HIV 周围的防护层杀死病毒。 参与研究的科学家摩尔表示, 研究人员已能复制抗体, 并将测试是否能在人体没感染下, 发挥免疫功能。 3.2.2 劫持细胞 2014 年 1 月,哈尔滨工业大学生命学院黄志伟研究组在国际上首次揭示了艾滋病病毒 毒力因子 Vif 的结构,阐明了 Vif 如何“劫持”人免疫细胞的分子机制,为研制全新艾滋病 药物提供了结构基础。该研究对人类最终攻克艾滋病具有重要意义和重要的科学应用价值。 作为艾滋病病毒九大基因中至关重要的影响因素,Vif 被学界认为是艾滋病病毒在传播 中针对人类进化而生,它通过“劫持”人免疫细胞内蛋白降解系统来降解人免疫细胞内的病 毒限制性因子 APOBEC3 家族成员, 从而逃避免疫细胞对艾滋病病毒的识别和防御。
但长久以 来,人们对 Vif 自身或者其功能性复合物的原子水平结构解析并未取得进展。 研究中,黄志伟研究组围绕 Vif 这一“顽疾” ,重点解析了 Vif 五元复合物结构,详细 描述了 Vif 如何“劫持”人 CBF-β 以及 CUL5 E3 连接酶复合物的分子机制。该研究分析了 艾滋病病毒的结构特征, 了解了艾滋病病毒是怎样与人结合, 为进一步解决艾滋病治疗难题 提供了可能。依照“按锁配匙”规律,该研究也为未来艾滋病治疗从“鸡尾酒式”的混合用 药方式,转向设计靶向治疗药物开辟了一条新路。 3.2.3 激活潜伏 来自 Gladstone 研究所的科学家们在《科学》杂志上报告称,他们找到了一种让潜伏 的 HIV 暴露自身的新方法,这或可帮助克服寻求治愈 HIV 感染所面临的最大的一个障碍。 他们发现, 无需提高 HIV 基因表达的平均水平, 只要提高与 HIV 基因表达相关的随机活性 (噪音) ,就可以重新激活潜伏 HIV。 当 HIV 感染免疫细胞之时, 它会将自身的遗传物质插入到感染细胞的 DNA 中。 在大多 数的情况下, 免疫细胞的机器装置会拷贝病毒遗传物质, 最终导致表达生成更多病毒所需的 所有元件。
新病毒从感染细胞中释放出来,会扩散感染机体其他的免疫细胞。 然而,在某些情况下, HIV 表达会进入等待模式,感染免疫细胞内的病毒进入到一种 潜伏状态。这意味着有一小部分的 HIV 匿藏在感染细胞中,即便是最有效的药物也无法触 及它们。 3.2.4 删除病毒2014 年 7 月,美国费城的研究人员们发现了一种可以彻底将 HIV 从人体细胞中删除的 方法,在一项发表在国家科学学术进程杂志的研究中,研究者首先将一种被称作核酸酶的 DNA 剪切酶和一种被称作指向核糖核酸的目标链结合, 随后这个组合便会开始追捕并最终除 掉 HIV-1 的病毒基因组。除掉之后,细胞的基因修复程序开始接管整个过程,将受损的两端 焊接起来,从而得到了一个无病毒的细胞。 由于 HIV-1 病毒无法被免疫系统清除, 只有去除掉病毒才可治愈这种疾病。 而这些分子 武器也可以当做疫苗使用,武装上核酸酶-核糖核酸的细胞已被证实不受 HIV 病毒的感染。 研究室使用一种 20 核苷酸链的指向核糖核酸来定位 HIV-1 病毒,随后使用一种被称作 Cas9 的 DNA 剪切酶来修改人体基因组。研究者已经想出了不同的策略应用到临床前的研究 当中,希望能消除患者身上的每一份 HIV-1 病毒,才能治愈艾滋病。
4 总结 艾滋病是一种严重的传染病,至今无有效疗法治愈,只能适当延长患者的生命。所以更 要洁身自好,以免给家庭社会带来痛苦和负担。研究表明,艾滋病与我们的一般性接触,例 如握手,拥抱,共用餐具、洁具和卧具,共用游泳池、咳嗽、打喷嚏以及蚊虫叮咬等是不会 传播。同时,对于 HIV 携带者和 AIDS 患者,他们在经受巨大身体痛苦的同时,更受着精神 上的巨大折磨,我们更需要给予他们关注和关爱,也更要珍爱自己的生命。
/uploads/",@me) /}