7 月 20 日,IAS 2023(International AIDS Society,国际艾滋病协会)在科学亮点新闻发布会中披露了一项最新艾滋病治愈患者的病例信息 [1]。并于北京时间今晨 7 点,公布了病例的口头报告。

图源:IAS 2023
摘要中表明,该患者在干细胞移植后,且没有接受抗逆转录病毒治疗的情况下,艾滋病病毒已缓解了 18 个月。
而与此前几例治愈病例不同的是,在该患者接受的移植干细胞中,并不存在 CCR5-delta-32 突变。
停止抗病毒治疗 18个月后,仍未检测到病毒载量
该患者被称为「日内瓦病人」,于 1990 年确诊艾滋病,2005 年起接受抗逆转录病毒治疗(ART)。2018 年,患者因白血病进行了化疗,随后又因双表型肉瘤(biphenotypic sarcoma)接受了干细胞移植。

图源:IAS 2023
在进行干细胞移植前,在病人体内可以检测到 HIV RNA(4 拷贝/ml)和HIV DNA(血液和骨髓中分别为 457 和 1096 拷贝/百万细胞)。
移植后一个月,测试显示患者的血细胞已完全被供体细胞取代。同时,患者进行的 ART 治疗也逐渐减少,并于 2021 年 11 月最终停止。
迄今为止,患者体内的HIV RNA 已经连续 18 个月无法检测出,前病毒 DNA 也下降到低水平(4~40 拷贝/百万细胞)。这表明,「日内瓦病人」已经达到 HIV 缓解,很有可能成为又一名艾滋病治愈患者。
此前,全球共有 5 位病人通过异体干细胞移植达到了艾滋病「治愈」,分别是:柏林病人、伦敦病人、杜塞尔多夫病人、纽约病人和希望之城病人。五位病人均接受了干细胞移植(除纽约病人移植的干细胞来自脐带血以外,其余几例所移植的干细胞均来自骨髓)。
在这 5 例艾滋病病人中,一个共同的特点是,所有病人接受移植的干细胞均存在一种罕见的基因突变——CCR5-delta-32。
CCR5-delta-32 是由于 CCR5 编码基因发生突变、第 32 对碱基缺失产生的突变基因。HIV 在进入人体破坏 CD4+T 细胞时,需要一个通道,这个通道上有关键的一个受体,它是通道的「领路人」。CCR5 就是其最主要的辅助受体之一。
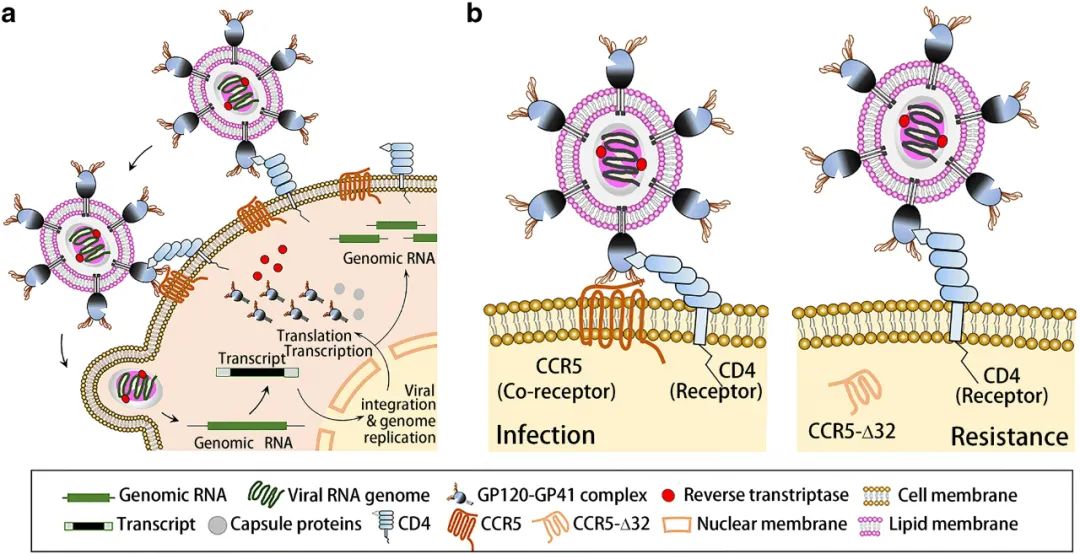
HIV感染过程(a),CCR5 在 HIV 感染中的分子机制及细胞质 CCR5-Δ32 对 HIV-1 感染的保护作用(b)(图源:参考资料 2)
具有 CCR5-delta-32 基因的人,由于缺失了一段编码,导致基因不能够编码成熟的 CCR5,从而其体内的 CD4+T 细胞表面无 CCR5 的存在。因此,HIV 无法识别到 CCR5,也就无法通过其进入 CD4+T 细胞,达到复制和破坏细胞的目的。而此前五例患者接受移植的干细胞,就来自拥有这种基因突变的特殊人群。
但是,在此次「日内瓦病人」所移植的干细胞中,却不含 CCR5-delta-32。捐赠者拥有正常干细胞,意味着他们容易感染艾滋病毒,而接受移植的患者可能也会因此出现病毒反弹。
尽管如此,「日内瓦病人」的治疗案例依然为研究人员带来鼓舞,因为这或许能够表明,使用带有 CCR5-delta-32 突变的干细胞并不是实现艾滋病长期缓解所必需的。
从药物治疗到干细胞移植
1981 年 6 月,自美国疾病预防控制中心通报全球首例艾滋病毒感染案例以来,医疗界便一直竭力寻找着治愈艾滋病的方法。1987 年,第一个抗 HIV 药物齐多夫定(AZT)获得 FDA 批准上市。
作为一种核苷类似物逆转录酶抑制剂(NRTI),齐多夫定通过抑制 HIV 逆转录酶,从而减少病毒的复制。然而,仅凭一种药物难以长时间抑制病毒,患者仍然不可避免地死亡。直到 1995 年,何大一教授发明的鸡尾酒疗法,让艾滋病治疗领域初现曙光。

1996 年,何大一被《时代》杂志评选为年度人物,并登上杂志封面。(图源:TIME)
鸡尾酒疗法是将两大类当时已有的抗艾滋病药物(逆转录酶抑制剂和蛋白酶抑制剂)中的 2~4 种组合在一起使用,也被称为「高效抗逆转录病毒治疗方法(HARRT)」。此举大幅减低了艾滋病患者的死亡率,和各种机会感染和肿瘤的发生率。
同时,研究证实,抗逆转录病毒还能降低血液和生殖器分泌物中的病毒量,从而降低感染 HIV 的传播风险,做到「治疗即预防」,对个人和公共健康都有益处 [3]。但长期服药的高昂成本、药物毒副作用、停药后的病毒反弹等问题也成为了鸡尾酒疗法的局限。
2007 年,世界首个通过骨髓移植治愈艾滋病的患者——「柏林病人」出现了[4]。该患者因急性髓细胞白血病而进行骨髓移植,在配型到的造血干细胞恰好带有 CCR5-delta32 突变基因。移植手术后,他体内的 CD4+T 细胞中均未发现具有复制能力的 HIV-1 前病毒,达到了「清除性治愈」。直至他在 2020 年 9 月因为淋巴瘤复发去世,13 年间从未发生过 HIV 病毒反弹。

柏林病人, Timothy Ray Brown。2010年,他公开了自己的名字,并在此后一直支持艾滋病治疗研究。(图源:NIH)
而在此后将近十年的时间里,「柏林病人」始终是唯一一例被成功治愈的患者。直到 2019 年 3 月,世界上第二例 HIV 治愈案例「伦敦病人」的出现,才让「柏林病人」不再孤单,也再次证明了利用 CCR5 突变的造血干细胞移植治疗艾滋病的可能 [5-6]。
2019 年,邓宏魁教授与陈虎教授、吴昊教授研究组在 ΝΕJM 发表的研究报道了使用 CRISPR 技术编辑造血干细胞中的 CCR5 后进行移植的方法,此举有望帮助更多的艾滋病患者[7]。

图源:参考资料 7
如今,CRISPR/Cas9 及其相关系统作为一种新型基因组编辑技术,已被广泛用于艾滋病治疗研究领域。但关于艾滋病治疗探索的脚步,却从来没有停下。
2020 年,Science 报道了一位来自巴西圣保罗的艾滋病患者 [8]。该患者采用了 5 种抗艾滋病药物与烟酰胺联用的激进的治疗方案。在停止 ART 治疗 66 周内,均未在患者血液中检测到任何 HIV 病毒。

图源:Science
然而艾滋病治愈,就在治疗中断的第 72 周,「圣保罗病人」出现发烧、头痛、腹泻等症状,经检测发现病毒载量超过 6300 拷贝/mL。这次崭新的治疗尝试,最终也以失败告终 [9-10]。
「日内瓦病人」的成功能否复制?
事实上,在「日内瓦病人」之前艾滋病治愈,还有两位病人接受了同样的治疗。
2013 年,IAS 会议上曾报道了两位来自波士顿的病人,他们分别于 2008 年、2010 年接受了不含 CCR5-delta-32 基因突变的野生型 CCR5 供体细胞的干细胞移植,并在移植完成后中断了 ART。
但根据后续在 Nature 发布的相关报告显示:中断 ART 后,一名患者在 3 个月后,体内再次检测到 HIV 病毒;而另一位患者则在治疗中断 8 个月后再次检测到 HIV 病毒 [11]。目前,两位患者均已恢复使用抗逆转录病毒药物治疗。

图源:Nature
「波士顿病人」的案例表明,「日内瓦病人」或许也将面临同样的再感染的风险。值得庆幸的是,这位日内瓦患者在无需治疗的情况下,已经实现了 18 个月的 HIV 缓解。
IAS 的主席 Sharon Lewin 认为:「基于此前两位波士顿病人的案例,我对于日内瓦病人的治疗案例仍保持谨慎,因为即使是单个病毒体也可能导致艾滋病病毒反弹。在未来的数月到数年里,日内瓦病人的情况需要受到密切监视。」
艾滋病患者治愈情况梳理干细胞移植治愈患者
「柏林病人」:世界第一例艾滋病治愈病人,采用骨髓干细胞移植,于 2020 年去世。
「伦敦病人」:世界第二例艾滋病治愈病人,采用骨髓干细胞移植,2020 年柳叶刀发文确认。
「杜塞尔多夫病人」:世界第三例艾滋病治愈病人,采用骨髓干细胞移植,2023 年 Nature 发文确认。
「纽约病人」:艾滋病可能治愈者,全球经首例脐带血干细胞移植达到 HIV 缓解,2022 年初次披露。
「希望之城病人」:艾滋病可能治愈患者,采用骨髓干细胞移植,2022 年初次披露。
「日内瓦病人」:艾滋病可能治愈患者,采用不含 CCR5-delta-32 突变的骨髓干细胞移植,2023 年初次披露。
可能自愈患者
「旧金山病人」:第一例艾滋病可能自愈病人,2020 年初次报告。
「埃斯佩兰萨病人」:第二例艾滋病可能自愈病人,2021 年报告。
药物可能治愈患者
「圣保罗病人」:可能通过药物治愈的艾滋病病人,但最终以失败告终。
致谢:本文经北京协和医院感染内科主任、中华医学会感染病学分会主任委员兼艾滋病学组组长 李太生教授、解放军总医院第五医学中心副研究员 张超专业审核
参考文献
[1]
[2]Xu, M. CCR5-Δ32 biology, gene editing, and warnings for the future of CRISPR-Cas9 as a human and humane gene editing tool. Cell Biosci 10, 48 (2020).
[3]Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011;365(6):493-505. doi:10.1056/NEJMoa1105243
[4]Brown TR. I am the Berlin patient: a personal reflection. AIDS Res Hum Retroviruses. 2015;31(1):2-3. doi:10.1089/AID.2014.0224
[5]
[6]Gupta, R.K., et al., Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report. Lancet HIV, 2020.3.Wei, X. and R. Nielsen, CCR5-∆32 is deleterious in the homozygous state in humans. Nature Medicine, 2019. 25(6): p. 909-910.
[7]Xu, L., et al., CRISPR-Edited Stem Cells in a Patient with HIV and Acute
Lymphocytic Leukemia. New England Journal of Medicine, 2019. 381(13): p. 1240-1247
[8]
[9]
[10]
[11]
本文来自微信公众号,作者:丁香园 DXY,36氪经授权发布。
/uploads/",@me) /}