投稿及建议请联系:bz9305

抗逆转录病毒治疗(ART)的推广应用使艾滋病得到了有效控制,延长了HIV患者的平均预期寿命治愈艾滋病,但药物治疗仅能抑制病毒复制,潜伏在病毒储存库中的病毒却很难被清除,病毒储存库是HIV感染功能性治愈最主要的障碍。近日,APACC和IAS大会相继召开,带来了HIV病毒储存库的相关研究进展,一起来先睹为快!
01聚乙二醇干扰素-α-2a联合利巴韦林治疗可能会增加HIV-1/HCV共感染患者的HIV-1储存库[1]聚乙二醇干扰素-α-2a(IFN-α-2a)和利巴韦林治疗对HIV-1/HCV共感染患者的细胞相关HIV-1 DNA的影响目前尚不清楚。病毒生长试验(VOA)可能是迄今为止最可靠的HIV-1储存库测量方法。一项由中国广州市第八人民医院、中山大学中山医学院开展的临床研究显示,IFN-α-2a联合利巴韦林(PR方案)治疗可能会增加HIV-1/HCV共感染患者的HIV-1储存库。

研究共纳入了21例接受ART治疗超过1年、CD4+细胞计数>200细胞/μl且HIV-1 RNA低于20拷贝/ml的HIV-1/HCV共感染患者,其中14例为男性,中位年龄为40岁。所有患者接受PR方案治疗。并在0、12周、24周、48周和72周进行随访,收集所有患者的外周血单核细胞进行检测细胞相关HIV-1 DNA水平,随机选择6位患者通过VOA分析HIV-1储存库的复制能力。24周HCV RNA水平降低至检测下限的患者停止PR方案,并认为获得了持续病毒学应答(SVR)。分析结果显示:
接受PR方案治疗的患者SVR 24周为61.9%,PR治疗期间CD4+细胞计数显著降低(12周p=0.005;24周p=0.014),并在后续恢复至治疗前水平(p>0.05)。CD4+/CD8+ 比值随时间增加,在第 48 周增加至最大峰值(P=0.012),但随后降至治疗前水平(P > 0.05);
在接受IFN-α-2a治疗的前24周内治愈艾滋病,细胞相关HIV-1 DNA 和具有复制能力的HIV-1基因组水平均保持平稳(P均> 0.05);
具有复制能力的HIV-1基因组水平在PR方案治疗结束时(即48周)增加(但无统计学差异,P = 0.053),然后在完成PR方案治疗后24周降至治疗前水平(P > 0.05 )。此外,尽管变化幅度较小,但细胞相关 HIV-1 DNA 水平的变化趋势与具有复制能力的HIV-1基因组的变化趋势一致。

02早期启动ART治疗可使酪氨酸激酶抑制剂诱导的HIV-1外周储存库减小[2]
研究表明,早期启动联合抗逆转录病毒疗法(cART)治疗可能限制HIV储存库的大小,并使治疗中止后仍可实现持续病毒抑制(SVS)。今年IAS大会上,M.A. Diallo报道了一项最新研究,探讨了年龄、SVS和早期启动cART对垂直感染HIV的儿童和青少年细胞储存库的大小和动态变化的影响。
研究纳入55例EPIC4队列的儿童受试者,平均进行18个月的前瞻性随访,并根据年龄(无论患者年龄,与一过性病毒血症组和SVS组患者相比,未达到SVS组受试者的ICF水平最高(p

在SVS受试者中,病毒库大小保持稳定(中位斜率为0.00,IQR=-0.23-0.03),在一过性病毒血症受试者中病毒库大小变化最大(中位斜率为-0.44,IQR=-0.85-0.00);
ICF水平与SVS所致累积寿命呈负相关(p研究结果表明,在早期开始cART并达到SVS的经垂直感染HIV的儿童和青少年中,诱导性病毒储存库减小。并且,随着时间推移,一过性病毒血症影响储存库大小的变化,从而证实这些一过性病毒生产高峰的生物学和潜在的临床意义。

03通过螺内酯降解XPB可防止潜伏期HIV-1再激活[3]

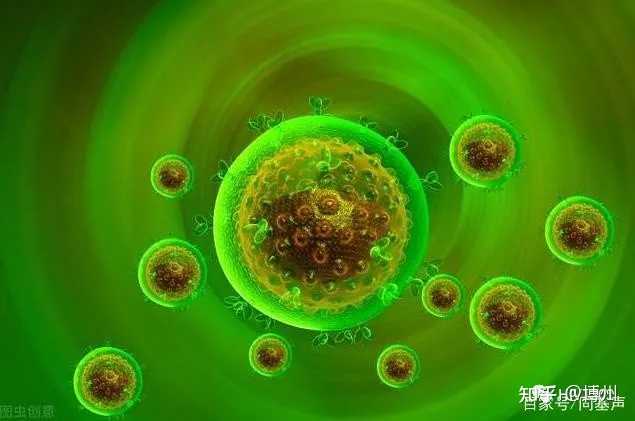
HIV转录抑制剂在block-and-lock疗法中具有巨大的潜力。block-and-lock疗法旨在通过阻断HIV再激活和锁定病毒库来实现治愈。HIV更倾向于整合到宿主DNA的活性转录区域,这提示整合酶抑制剂有助于锁定HIV储存库。有研究者利用整合酶抑制剂( LDGEF/p75 inhibitors,LEDGINs )抑制HIV整合酶与LEDGF/p75宿主辅助因子相互作用,重新靶向HIV整合,使原病毒即使使用潜伏逆转剂(LRAs )也更难再激活(如下图)[4]。
但是,目前临床上还没有HIV转录抑制剂。HIV的转录需要在HIV启动子处组装细胞转录因子。TFⅡH通用转录因子通过开放转录起始位点周围的DNA链和磷酸化C端结构域来促进RNA聚合酶Ⅱ( RNAPII )的激活,从而促进转录起始。螺内酯(SP )是醛固酮拮抗剂,在体外可引起TFⅡH的XPB亚基蛋白酶体降解,同时阻断HIV的转录。研究者在HIV-1潜伏期的原代和细胞系模型中研究了SP的再活化作用。
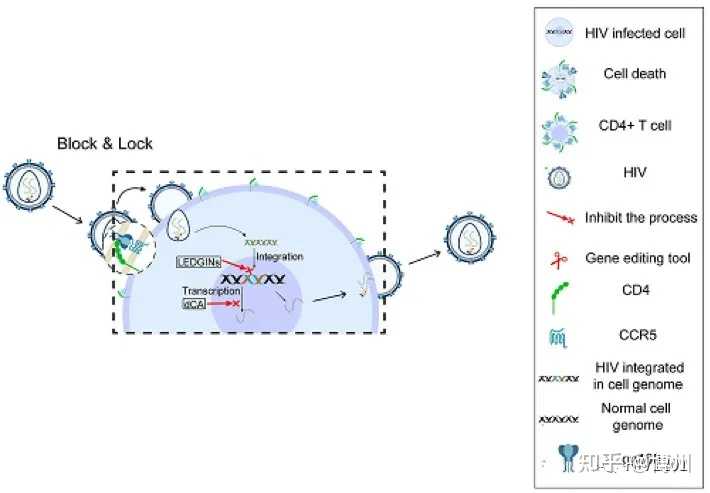
block-and-lock疗法机制[4]

从HIV感染者中分离的HIV潜伏期和原代CD4+T细胞,用10uM SP处理,可使XPB最大程度降解。L. Mori等探究了ART对残余病毒转录的影响、RNAPII在HIV基因组中的募集、潜伏期再激活以及对细胞转录的整体影响。结果如下:
SP通过减少RNAPII募集到HIV-1基因组而快速、选择性地抑制HIV-1转录;
虽然SP单一用药可强烈抑制HIV的转录,但SP长期预处理在SP治疗中断时不会导致对HIV的表观遗传抑制,因为当XPB再次出现时,病毒会迅速反弹;
潜伏逆转剂刺激细胞后,SP在细胞系模型和从HIV感染者中分离的静息CD4+T细胞中均可抑制潜伏期HIV再激活。
从上述结果,我们可得出结论:XPB在HIV转录调控中起到关键作用,是一种新型block-and-lock治疗靶点。SP与其他潜伏促进剂联用可减少ART作用下潜伏病毒库的残余病毒转录,并使病毒库永久表观遗传沉默。
总结HIV抗病毒治疗已经取得巨大进步,但功能性治愈仍面临巨大的挑战,最大的难点在于无处不在的病毒储存库,HIV储存库的清除是实现艾滋病治愈的关键。今年的APACC和IAS大会给出了多项前沿研究结果,我们相信这些研究将为实现艾滋病的功能性治愈提供多种思路。
/uploads/",@me) /}