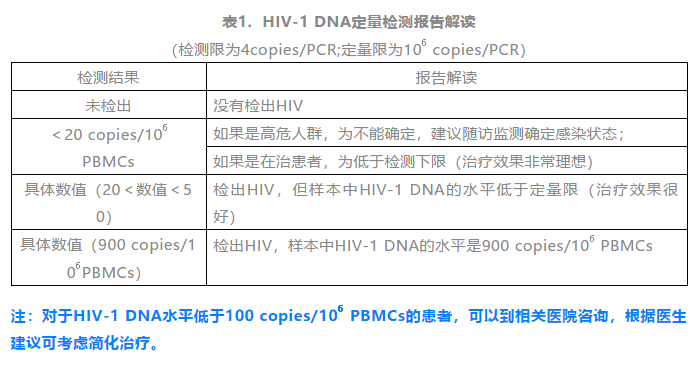
近年来,有哪些重大的HIV疫苗研究或发现呢?生物谷小编梳理了一下生物谷报道的HIV疫苗研究方面的新闻,供大家阅读。
HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。
目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。 虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
Science子刊:最新临床试验表明一种有前景的HIV疫苗表现出交叉保护性的迹象
doi:10.1126/scitranslmed.aax1880
在泰国开展的RV144疫苗临床试验是迄今为止唯一显示抗HIV感染效果的HIV疫苗(NEJM, 2009, doi:10.1056/NEJMoa0908492)。虽然据估计疫苗效力(estimated vaccine efficacy)在第12个月高达60%,但是到第42个月时,它减少到31.2%(Lancet Infectious Diseases, 2012, doi:10.1016/S1473-3099(12)70088-9)。
RV144在HIV-1 B亚型毒株CRF01_AE占主导地位的泰国开展,旨在评估异种初免-加强联合疫苗接种方案。进行四次疫苗注射:在第0月时,注射ALVAC-HIV(vCP1521);在第1月时,注射表达包膜蛋白(Env, HIV-1 E亚型)的金丝雀痘病毒载体;在第3月时,注射组特异性抗原(Gag, HIV-1 B亚型);在第6月时,注射蛋白酶(Pro, HIV-1 B亚型)。此外,还进行两次加强疫苗注射:在第3月时,注射以明矾作为佐剂的AIDSVAX B/E;在第6月时,注射双价HIV糖蛋白120(gp120)。
所有之前的研究都探究了RV144临床试验中与疫苗效力相关的潜在因素,而且都涉及对接受疫苗接种的HIV感染者和未感染者(即病例对照研究)进行回顾性评估,或通过比较疫苗接种组和安慰剂组之间的HIV感染情况进行遗传筛选分析。
在一项新的研究中,为了前瞻性地评估这些相同的与感染风险相关的免疫反应是否在南非人体内激活出来,来自南非和美国的研究人员利用含有HIV-1 C亚型和E亚型序列的RV144疫苗接种方案在南非开展HVTN 097临床试验。特别地,他们将在南非参与者中观察到的免疫反应的幅度和频率与之前在泰国RV144参与者中观察到的情形进行了比较,这是因为这涉及感染风险的相关因素和与这些相关因素相关的潜在HIV-1亚型交叉免疫反应。相关研究结果发表在2019年9月18日的Science Translational Medicine期刊上,论文标题为“Immune correlates of the Thai RV144 HIV vaccine regimen in South Africa”。

图片来自Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aax1880。
HVTN 097临床试验在南非评估了这种疫苗方案。他们比较了HVTN 097和RV144疫苗接种者样本在峰值和持久性免疫原性时间点的细胞免疫反应和体液免疫反应,并评估了疫苗匹配的和HIV-1亚型交叉的免疫反应。
在峰值免疫原性(peak immunogenicity)时,相比于RV144疫苗接种者,HVTN 097疫苗接种者表现出显著更高的细胞免疫反应和体液免疫反应。无论年龄和性别如何,在HVTN 097中,CD4+ T细胞反应更频繁出现,而且CD4+ T细胞Env特异性功能评分更高。在HVTN 097中,Env特异性CD40L+ CD4+ T细胞更常见,具有这种表达模式的个体对HIV-1 Env表现出更高的中值抗体反应。
在HVTN 097中,针对gp120疫苗和V1V2疫苗匹配抗原的IgG和IgG3结合抗体率和反应幅度比RV144 ADCC更高或相当,并且抗体依赖性细胞吞噬作用(ADCP)功能性抗体反应在HVTN 097中诱导出。Env特异性IgG和CD4+ Env免疫反应在HVTN 097和RV144临床试验中均随时间的推移显著下降。
总体而言,在南非,与免疫保护相关的HIV-1亚型交叉免疫反应比预期的要好,这表明这种疫苗方案具有更广泛的适用性。
Science子刊:揭示出一种B细胞基因表达特征与疫苗抵抗HIV感染相关
doi:10.1126/scitranslmed.aaw4236
在一项新的研究中,来自美国沃尔特里德陆军研究所等研究机构的研究人员在五项独立的HIV-1候选疫苗临床试验中鉴定出一种与免受SIV或HIV感染相关的B细胞转录特征。
他们发现这种基因表达特征与唯一的一项之前已显示有适度功效的人类HIV疫苗RV144的临床试验中免受HIV感染相关。相关研究结果近期发表Science Translational Medicine期刊上,论文标题为“A vaccine-induced gene expression signature correlates with protection against SIV and HIV in multiple trials”。
这种基因表达特征和特异性基因之前已被证实是由在人类中进行流感和黄热病疫苗接种诱导出来的。论文通讯作者、沃尔特里德陆军研究所美军艾滋病毒研究计划(U.S. Military HIV Research Program, MHRP)宿主基因组学主任Rasmi Thomas博士说,“我们认为这种B细胞特征是疫苗接种后有效反应产生的一个广泛指标,可能有助于设计有效的针对HIV和其他病原体的疫苗。”
从更广泛的角度讲,Thomas说,这项研究中使用的RNA测序(RNA-Seq)方法可被证明是一种在其他临床试验和临床前试验中发现保护性相关因素的有价值工具。
这些研究人员研究了来自HIV-1候选疫苗临床前试验的RNA-Seq数据。他们猜测在这些临床前研究中观察到的部分功效可能是由于试验性疫苗引起的宿主基因表达变化。通过在HIV临床试验中首次使用称为RNA-Seq的新一代测序方法,他们在非人类灵长类动物中观察到了一种共同的保护性基因特征。
接下来,这些研究人员研究了这种B细胞特征是否与唯一的一项已表现出适度功效的人体HIV疫苗(RV144)临床试验中免受HIV感染相关联。这项临床试验是由MHRP与其合作伙伴在泰国共同开展的。RV144使用了一种与非人类灵长类动物研究中使用的完全不同的疫苗Pox-蛋白方案。
这种与临床前研究中的免受SIV感染相关的B细胞特征也与RV144人体疫苗功效临床试验以及MHRP开发的另外2种Pox-蛋白疫苗中的免受HIV感染相关。这种B细胞特征还与更高水平的功能性抗病毒抗体反应---称为抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis, ADCP)---相关,这有助揭示HIV疫苗RV144为何具有保护作用。
Science子刊:HIV疫苗新策略!利用抗独特型抗体激活表达广泛中和抗体的前体B细胞
doi:10.1126/scitranslmed.aay7699
诱导保护性的广泛中和抗体(broadly neutralizing antibody, bNAb)产生是成功接种疫苗的关键策略。然而,对于许多重要的全球性疾病,如艾滋病和流感,人们尚未实现高效的疫苗接种。一种开发新疫苗的策略专注于鉴定出病原体上的特定脆弱靶标,疫苗诱导出的保护性抗体应当能够靶向这些脆弱的靶标。对于HIV感染而言,这种方法专注于鉴定bNAb的靶标,bNAb是在一小部分HIV感染者体内产生的,并且可以介导免受多种HIV毒株的入侵。尽管已鉴定出针对HIV-1包膜蛋白(Env)的多个bNAb靶标,但迄今为止,基于特定结构的Env免疫原的多种疫苗方法未能在人体中诱导出保护性的bNAb。
在一项新的研究中,为了采取一种新方法来解决这个问题,Bancroft等人研究了是否能够利用抗独特型抗体(anti-idiotype antibody)进行疫苗接种。他们以产生一种称为b12的HIV-1 bNAb的生殖系B细胞作为研究对象,对这种HIV-1 bNAb而言,它能够识别的Env免疫原尚未被鉴定出。
为此,这些作者根据推断的bNAb b12生殖系版本开发出针对它的特异性抗独特型抗体。所产生的生殖系抗独特型抗体能够成功地从未感染HIV的供者体内的多克隆人B细胞库中鉴定出反应性的B细胞。然而,抗独特型抗体反应性的B细胞表达的B细胞受体与预测的生殖系b12前体分子仅具有中度的相似性。这种代表性不足可能是由于生殖系b12前体B细胞的自身反应性,这种自身反应性可导致这些特异性的B细胞在一种小鼠重链敲入模型中的缺失和无反应性。尽管如此,利用抗独特型抗体进行免疫接种克服了B细胞无反应性,从而导致靶B细胞的活化和靶B细胞进入生发中心。
Science子刊:一种新型CMV减毒活疫苗有望长期有效地抵抗HIV攻击
doi:10.1126/scitranslmed.aaw2607
基于巨细胞病毒(CMV)的疫苗载体具有较强的T细胞诱导和抵抗多种病原体的作用。然而,CMV对免疫缺陷或免疫抑制的人群是有害的。之前的研究已证实表达猴免疫缺陷病毒(SIV)蛋白的恒河猴巨细胞病毒(RhCMV)毒株68-1衍生性病毒载体(下称68-1 RhCMV/SIV)能够引发和维持细胞免疫反应,从而让恒河猴免受高度致病性SIV的粘膜攻击。然而,这些有效的68-1 RhCMV/SIV病毒载体具有复制和传播能力,因此有潜力在免疫受损的受试者中引起疾病。
为了开发一种更安全的基于CMV的临床用疫苗,在一项新的研究中,来自美国俄勒冈健康与科学大学、弗雷德里克国家癌症研究实验室和弗雷德-哈钦森癌症研究中心的研究人员通过剔除编码被膜蛋白pp71的Rh110基因(ΔRh110),减弱了68-1 RhCMV/SIV病毒载体的毒力,从而允许抑制裂解基因表达。相关研究结果发表在2019年7月17日的Science Translational Medicine期刊上,论文标题为“A live-attenuated RhCMV/SIV vaccine shows long-term efficacy against heterologous SIV challenge”。
关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
相比于毒力未削弱的68-1 RhCMV/SIV病毒载体,ΔRh110 68-1 RhCMV/SIV病毒载体在体内存在高度传播缺陷(即不能够在体内高效传播),传播能力下降了大约1000倍,但是它们仍然能够重复感染(superinfect)RhCMV阳性恒河猴,并且高频率地产生效应-记忆偏向性的T细胞反应。
这些研究人员证实表达同源或异源SIV抗原的ΔRh110 68-1 RhCMV/SIV病毒载体高度有效地抵抗阴道内SIVmac239病毒(SIV的一种高度致病性的毒株,是一种类似于HIV病毒的非人灵长类动物逆转录病毒)攻击:在59%的接受疫苗(指的是ΔRh110 68-1 RhCMV/SIV病毒载体)接种的恒河猴中,它控制着SIV感染并且渐进性清除SIV。此外,在12只接受疫苗接种后控制着初始SIV攻击并且渐进性清除SIV的恒河猴中,9只恒河猴能够在最后一次疫苗接种大约3年后严格地控制第二次SIV攻击,这证实了这种疫苗的持久性。
突破!Science子刊报道新型减毒HIV疫苗,安全无毒疗效佳!
doi:10.1126/scitranslmed.aaw2603
一种有望从猴子身上清除艾滋病病毒的疫苗距离人体试验又更近了一步,因为一种新的弱疫苗已被证明可以提供与原疫苗类似的保护。近日发表在《Science Translational Medicine》杂志上的两篇论文描述了这种疫苗--它使用了一种常见的巨细胞疱疹病毒(cytomegalovirus,简称CMV)--是如何被活减毒或削弱的,以便CMV不会轻易传播。
这种新的疫苗成功地消灭了59%的接种过疫苗的恒河猴体内的猴免疫缺陷病毒,即猴子版的HIV。这一结果与早期关于原始非减毒疫苗的结果相似。减毒疫苗产生的免疫力也很持久,因为接种疫苗的12只猴子中有9只在3年后仍能抵抗SIV感染。
疫苗毒性减弱是应用于人类的关键。出于安全考虑,没有疫苗使用非减毒活病毒。虽然人类感染巨细胞病毒后通常没有任何问题,但这种病毒可以对免疫系统薄弱的人造成严重破坏,比如器官移植患者。这对孕妇也是危险的,因为它会导致先天缺陷,如婴儿听力损失和小头畸形。
论文共同通讯作者Klaus fruh博士说:"这项使用恒河猴巨细胞病毒的研究为设计基于人类巨细胞病毒的HIV疫苗提供了潜在的重要理论。我们显着降低了巨细胞病毒毒性,并且仍然得到了与野生版本的这种疫苗相同的免疫反应。"
论文共同通讯作者医学博士Louis Picker说:"这些论文很重要,因为它们总结了之前报道过的独特的CMV载体的功效,该载体具有高度衰减的基因修饰,因此在临床使用中具有潜在的安全性。"此外,新研究还表明,大多数接种过疫苗的恒河猴在首次接种SIV疫苗数年后,也可以免受第二次感染。
Cell Rep:一种新型疫苗阻止HIV感染有戏!
doi:10.1016/j.celrep.2019.06.074
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员开发出一种由DNA和重组蛋白组成的新型疫苗,其中重组蛋白由一种HIV蛋白的一部分和另一种不相关的蛋白组成。这种疫苗在猴子身上进行了测试,测试结果表明它能够诱导出的抗体类似于与抵抗HIV感染相关的抗体。相关研究结果发表在2019年7月23日的Cell Reports期刊上,论文标题为“Multimeric Epitope-Scaffold HIV Vaccines Target V1V2 and Differentially Tune Polyfunctional Antibody Responses”。

图片来自Cell Reports, 2019, doi:10.1016/j.celrep.2019.06.074。
这些研究人员首先鉴定出HIV病毒的一部分,当与抗体结合时,会导致这种病毒和受到它感染的细胞遭受破坏。他们随后设计出一种可诱导这些类型抗体产生的疫苗。这种疫苗设计方法称为“反向疫苗学(reverse vaccinology,也译作逆向疫苗学)”。
这些研究人员鉴定出的HIV病毒靶标称为gp120包膜蛋白上的V1V2环。在针对接受用gp120 DNA和三种携带这种V1V2区域的新型重组蛋白接种的猴子开展的实验中,这种疫苗接种诱导出显示许多不同抗病毒功能的抗体。这些抗体属于在之前的人类临床试验中与HIV感染率下降相关的抗体类型。
Nature:开发出一种新的HIV免疫原---RC1
doi:10.1038/s41586-019-1250-z
广泛中和单克隆抗体(简称广泛中和单抗)可阻止动物模型中的HIV-1感染,这表明引发这些抗体的疫苗对人类具有保护作用。然而,迄今为止,人们尚未能通过疫苗接种诱导充足的血清学反应。在一项新的研究中,为了激活表达多克隆抗体库中广泛中和抗体的前体分子的B细胞,来自美国洛克菲勒大学和加州理工学院等研究机构的研究人员开发出一种称为RC1的免疫原,它便于识别HIV-1病毒包膜蛋白表面上的V3(variable loop 3, 可变环3)-聚糖片段(V3-glycan patch)。
相关研究结果近期发表在Nature期刊上,论文标题为“Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques”。
RC1通过在病毒样颗粒上添加聚糖和/或发生多聚化来隐藏非保守的免疫显性区域。用RC1对小鼠、兔子和恒河猴进行免疫触发了靶向V3-聚糖片段的血清学反应。对抗体-包膜蛋白复合物的抗体克隆和它们的低温电镜结构证实,用RC1进行免疫会扩大携带抗V3-聚糖片段抗体的B细胞克隆,这些抗V3-聚糖片段抗体类似于人广泛中和抗体的前体分子。
由此可见,就在多克隆抗体库背景下的连续疫苗接种策略而言,RC1可能是一种合适的启动免疫原(priming immunogen)。
Cell Rep:猴流感病毒未来可用于HIV疫苗的开发
doi:10.1016/j.celrep.2019.04.082
来自加利福尼亚州Scripps Research in La Jolla研究所一项新研究表明,一种可以感染猴子和猿的猴猿免疫缺陷病毒(SIV)的蛋白质具有开发抗人类免疫缺陷病毒(HIV)疫苗的潜力。在5月21日出版的Cell Reports上发表的这项研究中,斯克里普斯研究的科学家们发现,SIV的外包膜蛋白Env与HIV的Env共享一个关键结构,使SIV Env成为未来艾滋病毒感染疫苗的潜在组成部分。并且用SIV Env蛋白接种小鼠可以引发中和多种HIV毒株感染的抗体。
设计病毒疫苗的传统方法是使用弱化或工程化的病毒作为“免疫原”,刺激免疫系统产生保护性抗体。然而,病毒在感染期间迅速突变其外层结构,不断产生新的菌株或变体,可以逃避针对先前变体产生的抗体。以往开发针对一种类型艾滋病病毒株的疫苗对将来可能遇到的其它艾滋病毒毒株都无效。
作为一种替代方法,Burton的小组和其他人希望设计艾滋病疫苗,将抗体应答集中在病毒的少数真正易受攻击的部位。这些易受攻击的病毒结构被称作“广谱性中和表位”。由于该结构在病毒进化过程中相对保守,因此在实际应用中具有重要的价值。但这些结构往往隐藏在不易暴露的区域,因此开发识别该表位的疫苗具有不小的挑战性。
SIV Env似乎是一种潜在的良好免疫原,因为它具有广泛的中和表位V2-Apex,与HIV Env上的对应物几乎相同,但其他方面几乎没有相似之处。Andrabi及其同事设计了一种稳定的独立版本的SIV Env--一种通常由病毒外膜支持的三部分“三聚体”结构,接近人类HIV。
结果表明,在四周内接种SIV Env三聚体两次,引发了对HIV V2-Apex的所需的,狭窄靶向的抗体反应。抗体反应能够中和几种HIV分离株;使用HIV Env三聚体添加加强接种使得HIV中和反应更加广泛。
Cell:新的HIV疫苗递送策略可增强保护性的免疫反应
doi:10.1016/j.cell.2019.04.012
在一项新的研究中,来自美国斯克里普斯研究所、拉霍亚免疫学研究所和加州大学圣地亚哥分校等研究机构的研究人员报道一种新的HIV疫苗递送策略似乎在临床前模型中增强保护性的免疫反应。他们发现连续几天小剂量接种HIV疫苗要比一次性接种全部剂量的相同疫苗诱导更强的免疫反应。
相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Slow Delivery Immunization Enhances HIV Neutralizing Antibody and Germinal Center Responses via Modulation of Immunodominance”。
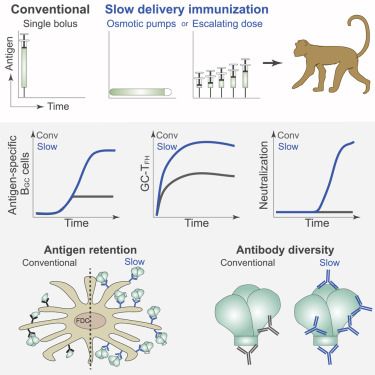
图片来自Cell, 2019, doi:10.1016/j.cell.2019.04.012。
一种类似的逐步增加疫苗接种剂量的方法在未来的临床试验中可能是一种递送HIV疫苗的最佳方式。论文通讯作者、拉霍亚免疫学研究所疫苗发现部门Shane Crotty教授说道,“这篇论文展示了这种方法的力量。”
对这项新研究而言,Crotty和他的同事们比较了三种疫苗剂量策略,以便观察是否有更好的机会促使中和抗体产生。来自美国耶基斯国家灵长动物研究中心的研究合作者在恒河猴中测试了这些策略,其中恒河猴是一种研究人体免疫系统如何应对HIV的最佳动物模型。
这些研究人员测试了三种疫苗接种策略:一种传统的疫苗,其中这种疫苗是一次性注射;一种“渗透泵(osmotic pump)”策略,在这种策略中,植入物有点像定时释放的药丸缓慢地递送疫苗;一种逐步增加剂量的策略,在这种策略中,动物每隔一天给予部分剂量的疫苗,持续12天。
正如Crotty所说,传统的疫苗导致了一种可预测的“糟糕”的免疫反应,这种免疫反应以非中和性抗体为主。这项实验随后变得有趣。令所有人吃惊的是,后面两种缓慢释放的策略不仅导致更多的抗体,而且导致更好的抗体产生。
JEM:利用CRISPR/Cas9对B细胞进行基因编辑有望开发出HIV疫苗
doi:10.1084/jem.20190287
人体不能自然地保护自己免受HIV病毒感染---至少通常不能做到这一点。但是,在极少数情况下,受感染的个体会产生对抗这种病毒的广泛中和抗体(bNAb)。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员设计出一种方法,将这种对抗HIV的能力赋予给普 通的免疫细胞。
相关研究结果于2019年4月11日在线发表在Journal of Experimental Medicine期刊上,论文标题为“HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells”。论文通讯作者为洛克菲勒大学的Michel C. Nussenzweig博士。
Nussenzweig和他的同事们使用CRISPR-Cas9基因编辑技术来修饰B细胞,即一种分泌抗体的白细胞。具体而言,他们对小鼠B细胞进行基因改造,使得它们自己产生人bNAb。他们发现,以这种方式发生改变的B细胞产生的抗体水平足以保护小鼠免受HIV感染,这表明这种技 术最终可能用作一种免疫工具。
虽然这项研究仍处于早期阶段,但是它证实了通过基因编辑增强免疫应答的可行性。重要的是,这种技术不会影响生殖细胞,因而避免了有时由CRISPR干预引起的伦理问题。如果能够实现,这种新的免疫方法不仅可以用于治疗HIV感染,而且还可以用于治疗任何对特定抗 体敏感的疾病。
/uploads/",@me) /}