人类免疫缺陷病毒(human immunodeficiency virus,HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。它属逆转录病毒科(Retroviridae)慢病毒属中的灵长类免疫缺陷病毒亚属的一种。HIV在感染后会整合入宿主细胞的基因组中,而目前的抗病毒治疗并不能将病毒根除。在艾滋病毒感染病程的一些时期,特别是早期及末期,具有感染性的病毒颗粒会存在于含有免疫细胞、血浆、淋巴液或组织液的某些体液中。
HIV的发现与命名
人类免疫缺陷病毒(HIV),诱发人类获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS即艾滋病)。过去还有人将其命名为LAV、ARV、IDAV和HTLV3,现统一命名为HIV。已知HIV病毒主要有两种,即HIV-1和HIV-2,其中HIV-2分M、N、O、P四个组,M组为全球主要流行组,HIV-2相对少见,主要局限于西部非洲。
1981年,人类免疫缺陷病毒在中美洲首次发现。1983年,法国巴斯德研究所的Montaginer和美国国家卫生研究院癌症研究所Gallo等人首次证明HIV是艾滋病的病因。2015年3月4日据外媒报道,HIV病毒已知的4 种病株,均来自喀麦隆的黑猩猩及大猩猩,是人类首次完全确定HIV病毒毒株的所有源头。目前已知HIV病毒毒株共有4种,分别是M、N、O、P,每种各有不同源头,其中传播最广的M和N早已证实来自黑猩猩,但较罕见的O和P则一直未能证实源头。研究员透过分析喀麦隆及邻近地区的黑猩猩及大猩猩基因资料,终于证实O和P均是来自喀麦隆西南部的大猩猩。全球至今只有两宗P型病例,O型亦只有10 万人,主要集中在中西非。

HIV病毒的形态结构
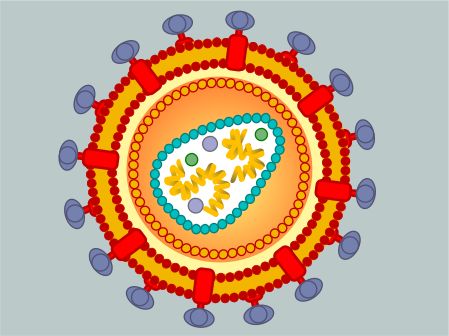
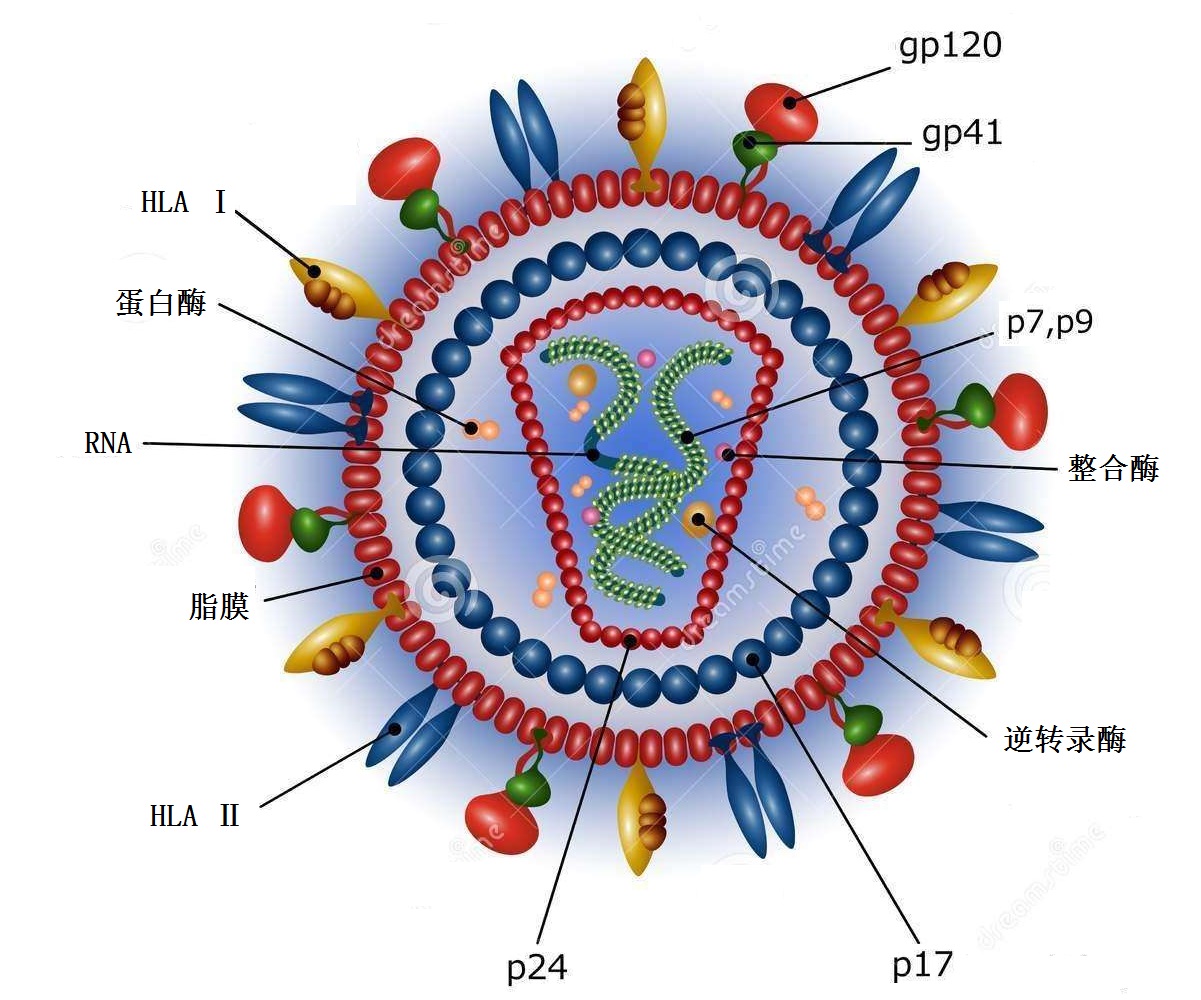
HIV病毒颗粒是一种直径约为100 nm的球状病毒,粒子外包被着由两层脂质组成的脂膜,这种结合有许多糖蛋白分子(主要是gp41和gp120)的脂质源于宿主细胞的外膜。蛋白质p24和p17组成其核心,内有基因组RNA链,链上附着逆转录酶,其功能是催化病毒RNA的逆转录。
HIV基因组及其编码的蛋白
HIV病毒为双链正链RNA病毒。基因组RNA长约9.6 kb,2 条RNA链通过5'端氢键结合形成二聚体。二聚体5'端和3'端各有1个帽状结构(m7G5'ppp5'GmpNp)和polyA尾。作为逆转录病毒家族成员,HIV基因组的结构与其他逆转录病毒类似,含有gag、pol和env三个基本结构基因,以及5' 端和3'端LTR结构。但HIV基因组较为复杂,它还包含了tat、rev、nef、vpr、vif、vpu(HIV-1)或vpx(HIV-2)等6个辅助或调节基因。
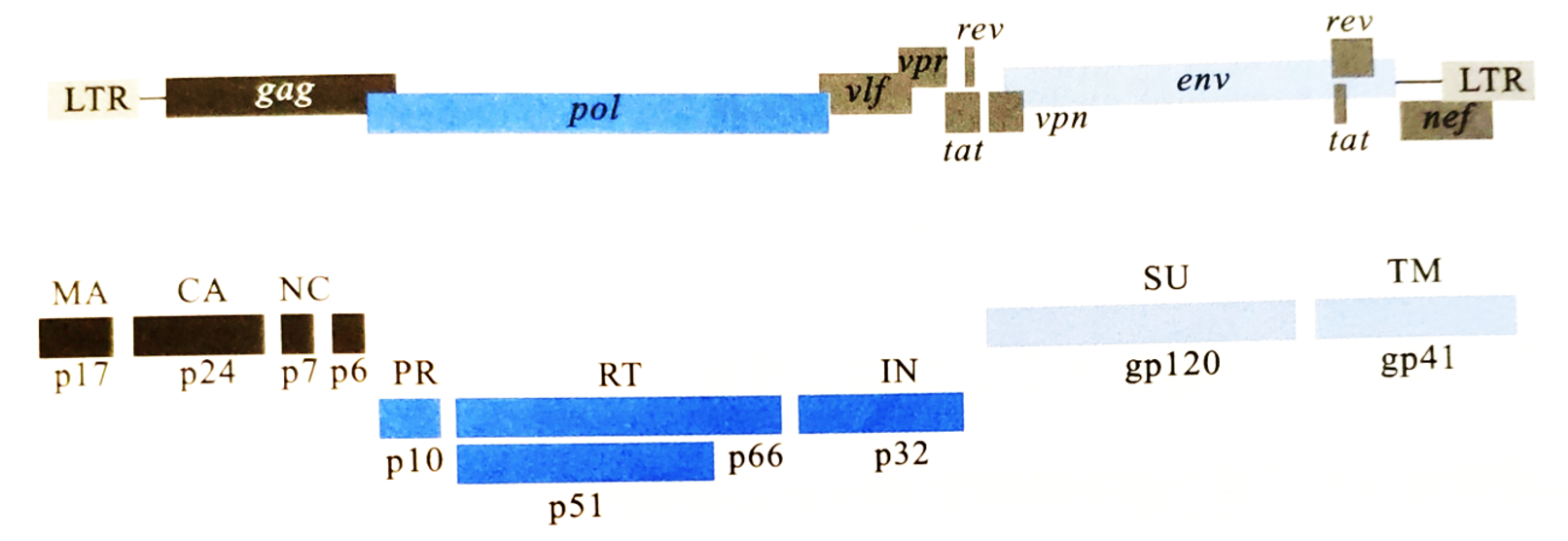
HIV结构蛋白主要包括4个基因。gag基因编码病毒的核心蛋白,翻译后被HIV蛋白酶切割成p17、p24和p15三个蛋白。p24和p17分别组成HIV颗粒的外壳(CA)和内膜蛋白(MA),p15进一步被切割成与病毒RNA结合的核衣壳蛋白(NC)p7和p6。pol基因编码病毒复制所需的酶类逆转录酶p66、整合酶p32。从pol和gag基因重叠区内起始的一段序列为PR基因,它编码蛋白酶p10,在切割上述HIV蛋白前体产生成熟蛋白的过程中起主要作用。env基因编码HIV包膜糖蛋白gp160的前体,该前体蛋白在蛋白酶作用下被切割成gp120和gp41,gp120为外膜蛋白,感染细胞时可与细胞的CD4受体蛋白相结合,gp41为跨膜蛋白(TM)hiv病毒,嵌入病毒包膜脂质中hiv病毒,当gp120与CD4受体结合后,其构象改变导致与gp41分离,独立的gp41可插入细胞膜,造成膜融合使病毒核心进入细胞内。
HIV的复制
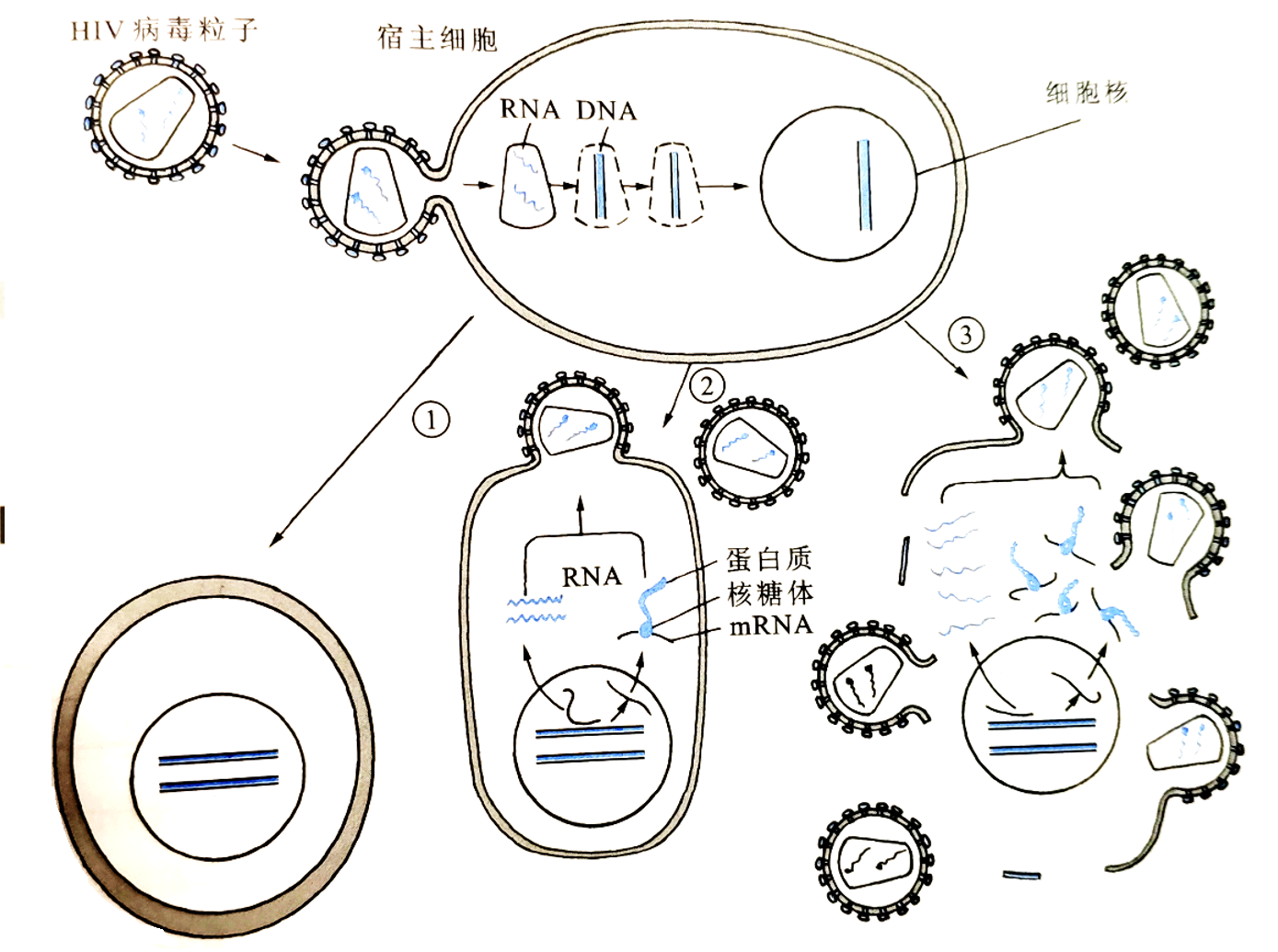
HIV通过病毒膜蛋白gp120与细胞表达的CD4受体蛋白结合,侵染人体的T细胞及巨噬细胞。HIV原病毒整合到宿主染色体上,无症状;原病毒利用宿主细胞的转录和合成系统转录产生病毒mRNA,其中一部分编码病毒蛋白,与基因组RNA组装成新的病毒颗粒,从宿主细胞中释放出来侵染其他健康细胞;最后宿主细胞瓦解死亡。
HIV的传播
HIV可以通过血液、母婴和性途径传播,性传播是其中主要传播方式之一。在性工作者中,高危性接触者感染HIV的概率是1%。当前性传播已成为HIV/AIDS的主要传播途径。近几年HIV在男同性恋者中新发病率升高,在男同性恋者中感染风险比普通人群高10倍以上。HIV在男-男、男-女、女-女性活动中的传播机制目前知之甚少,包皮环切术对HIV感染的防护效果表明:包皮是HIV进入男性尿道组织的重要部位。

最近的研究发现,艾滋病毒患者经长期鸡尾酒疗法治疗后,血液中可能检测不到HIV病毒,但是眼泪的病毒数量和新近确认艾滋病人血液中病毒含量相差并不大,推测泪腺和泪液等成为HIV病毒的新“据点”,但目前尚无眼泪传播HIV病毒的临床病例。
HIV的感染及致病机理
由于人体试验的局限性,对HIV早期感染过程的了解主要是通过猴免疫缺陷病毒(SIV)感染猕猴模型获得的。感染后1-3天,在黏膜细胞中是检测不到病毒颗粒存在的。大约3 天后,在黏膜表面一群表达CCR5休眠记忆CD4+T细胞中,可以检测到病毒颗粒。在接下来的3 天里,感染病毒的细胞数开始增加。大约1 周以内,病毒颗粒开始侵入局部淋巴结。70%以上的原发感染者在感染后2-4周内出现急性感染症状,包括发热、咽炎、淋巴结肿大、关节痛、中枢及外周神经系统病变、皮肤斑丘疹、黏膜溃疡等,持续1-2周后进HIV感染的无症状潜伏期。在这个时期感染者无任何临床症状,外周血中HIV抗原含量很低甚至检测不到。但随感染时间的延长,HIV重新开始大量复制并造成免疫系统损伤。人体免疫逐渐崩溃,艾滋病的症状开始出现。
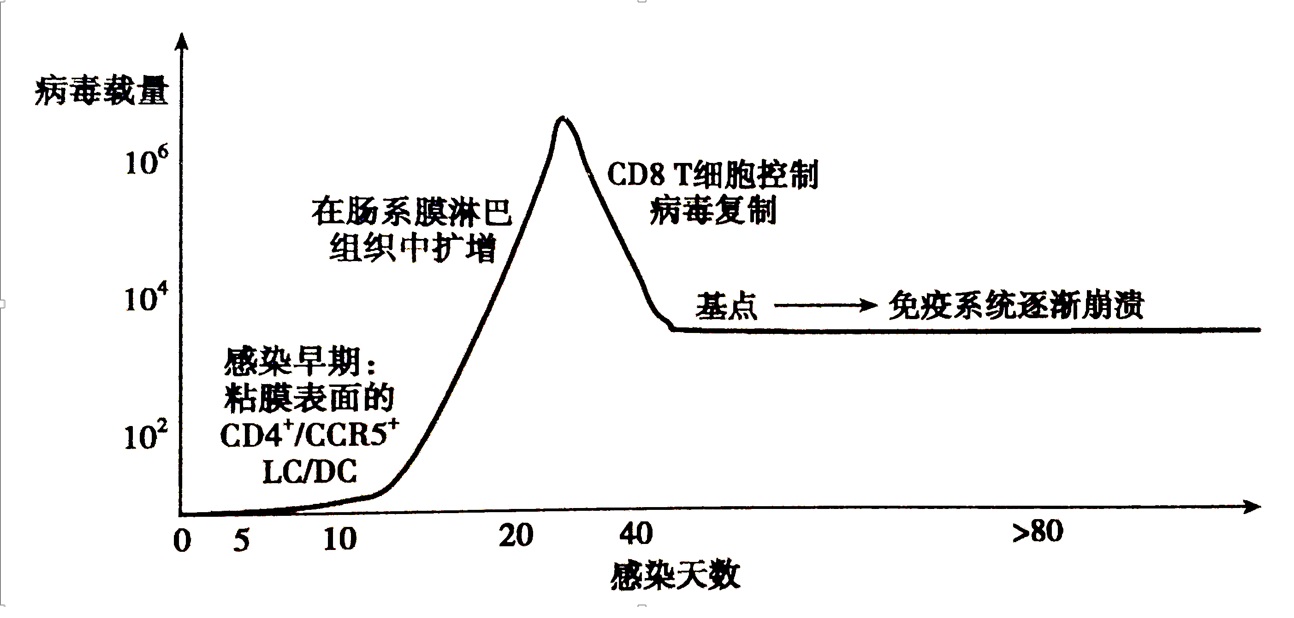
尽管感染者具有对带有HIV的细胞和体液的免疫反应,但在大多数情况下机体的免疫力不足以清除所有的HIV,所以,一经HIV感染便终生携带病毒,随着时间延续,发病的可能性也逐渐增加。与一般病毒感染不同,HIV感染的潜伏期可达数年,感染后7-8年内已有半数的感染者发病。产毒性HIV感染的最终结果是产生大量病毒颗粒,造成感染细胞死亡。HIV除在细胞内大师繁殖造成细胞死亡外,还可通过以下途径导致免疫功能下降:(1)HIV粒子表面的gp120蛋白脱落,与正常细胞膜上CD4受体结合,使该细胞被免疫系统误认为病毒感染细胞而遭杀灭;(2)因T细胞CD4受体被gp120封闭,影响了其免疫辅助功能;(3)HIV的gp120蛋白可刺激机体产物抗CD4结合部位的特异性抗体,阻断T细胞功能;(4)带有病毒包膜蛋白的细胞可与其他细胞融合形成多形核巨细胞而丧失功能。
艾滋病的治疗
目前,虽然对艾滋病的研究受到了高度重视,但仍无任何药物可以完全抑制HIV在感染者体内的增殖并彻底治愈艾滋病。已批准的抗HIV病毒药物主要有核苷酸逆转录酶抑制剂(如ABC、AZT等)、非核苷酸型逆转录酶抑制剂(如efavirenz、nevirapine和delavirdine)和蛋白酶抑制剂(如amprenavir、indinavir等)。
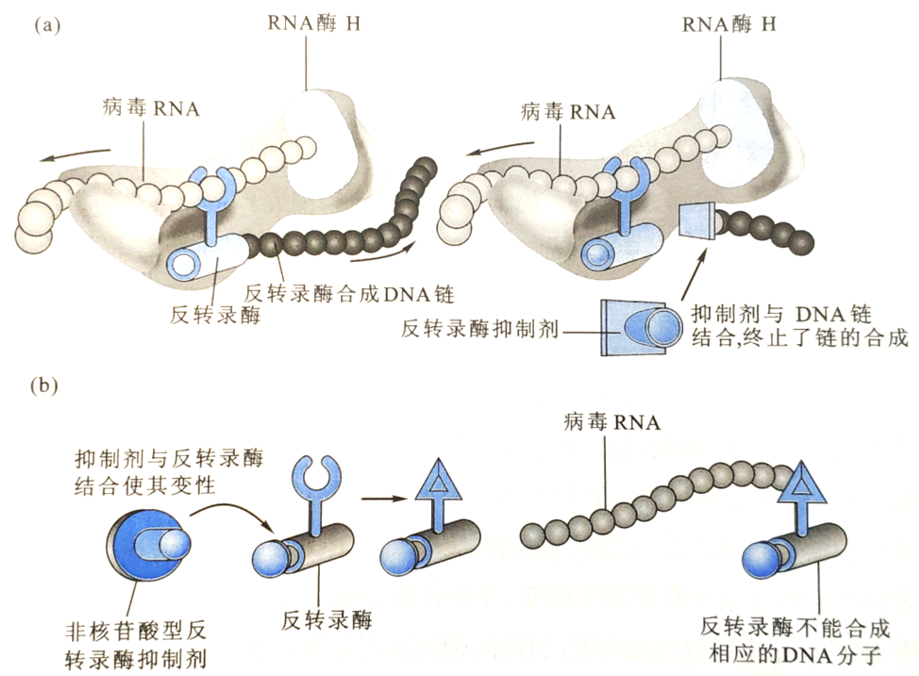
除了药物抗艾滋病外,还有基因疗法,疫苗。多种用于预防艾滋病的疫苗包括传统的减毒疫苗、灭活疫苗、重组病毒载体活疫苗、基因工程亚单位疫苗及合成寡肽疫苗等已经上市。由于HIV基因,特别是外膜蛋白的env基因高度变异,研制能有效抑制HIV病毒生长的疫苗难度很大。
近些年,艾滋病治疗领域获得重大进展,特别是对早期治疗的研究和功能性治愈患者的出现,高亲和力广谱中和抗体和高效潜伏激活剂的涌现,为艾滋病的治疗开辟了新的视角和方向。研究发现在HIV-1静脉吸毒感染者及同性和异性感染者中暴露前或暴露后治疗能够很大程度地降低HIV-1感染概率。继2009年移植CCR5Δ32供者的造血干细胞获得“治愈”的柏林病人之后,2019年“伦敦病人”也宣布潜在治愈。研究者和民众对艾滋病的治疗看到了希望:或许脱离AIDS终身治疗的时间不远了。
/uploads/",@me) /}