据世界卫生组织(WHO)数据,,截止到2017年11月,全球范围内有3500万人感染艾滋病病毒,目前,高活性抗逆转录病毒疗法(HAART)能够将HIV感染抑制在低于可检测水平。然而,HAART的成本高,且存在副作用和耐药性等限制。最重要的是它不能治愈HIV感染。因此,需要不断开发更有效的HIV感染治疗策略。
近日,中国医学科学院/北京协和医学院病原生物学研究所郭斐课题组在基因治疗领域著名期刊 Human Gene Therapy 杂志发表题为:CRISPR/Cas9 inhibits multiple steps of HIV‐1 infection的研究论文,使用CRISPR/Cas9技术成功抑制艾滋病病毒HIV-1的多个感染步骤。进一步探讨了CRISPR / Cas9抑制HIV-1感染的分子机制,并发现Cas9不仅在病毒DNA中导致插入缺失,而且降低了晚期病毒DNA产物和整合病毒DNA的水平。 数据还表明Cas9仅存在于细胞质中时能够编辑新合成的HIV-1 DNA并抑制病毒感染。


论文共同第一作者为:殷利眷、胡斯奇
关于CRISPR/Cas9系统的详细介绍请点击:CRISPR/Cas9:基因编辑的历史与发展。
使用基因组编辑来抑制HIV-1主要有两种策略。一种是使用CRISPR/Cas9编辑HIV-1共同受体CCR5,CXCR4或HIV-1复制所必需的其他细胞因子,从而保护基因修饰的原代CD4 + T细胞免受HIV-1感染。
另一种是hiv病毒,使用CRISPR/Cas9靶向病毒长末端重复(LTR)启动子DNA或病毒生存必须基因,从而灭活HIV-1病毒。
CRISPR/Cas9提供了一种新颖而强大的治疗工具,许多研究人员已经探索了这一工具可以在细胞和小鼠模型中成功抑制HIV-1感染。但这些研究大多是检测了Cas9对整合到宿主细胞基因组的HIV-1的的编辑效果。并不清楚Cas9在多大程度上影响细胞质中新合成的HIV-1 DNA。
在这项研究中,作者使用CRISPR/Cas9基因编辑系统,通过靶向病毒长末端重复序列和基因编码序列来抑制HIV-1感染。我们观察到Cas9/gRNA对HIV-1感染的强烈抑制作用,其不仅由于由于Cas9切割而导致病毒DNA的插入和缺失,还源于晚期病毒DNA和整合病毒DNA的显著降低。后者可能反映了Cas9切割后尚未立即修复的病毒DNA的降解。进一步观察发现,当Cas9完全位于细胞质中时,它与位于细胞核的Cas9一样强烈地抑制HIV-1,只是细胞质Cas9无法作用于整合的HIV-1 DNA,因此不能用于消除潜伏期病毒。
总之,研究结果表明Cas9/gRNA能够靶向和编辑细胞质和细胞核中的HIV-1 DNA。Cas9对HIV-1的抑制作用归因于病毒DNA的插入和缺失以及病毒DNA水平的降低。
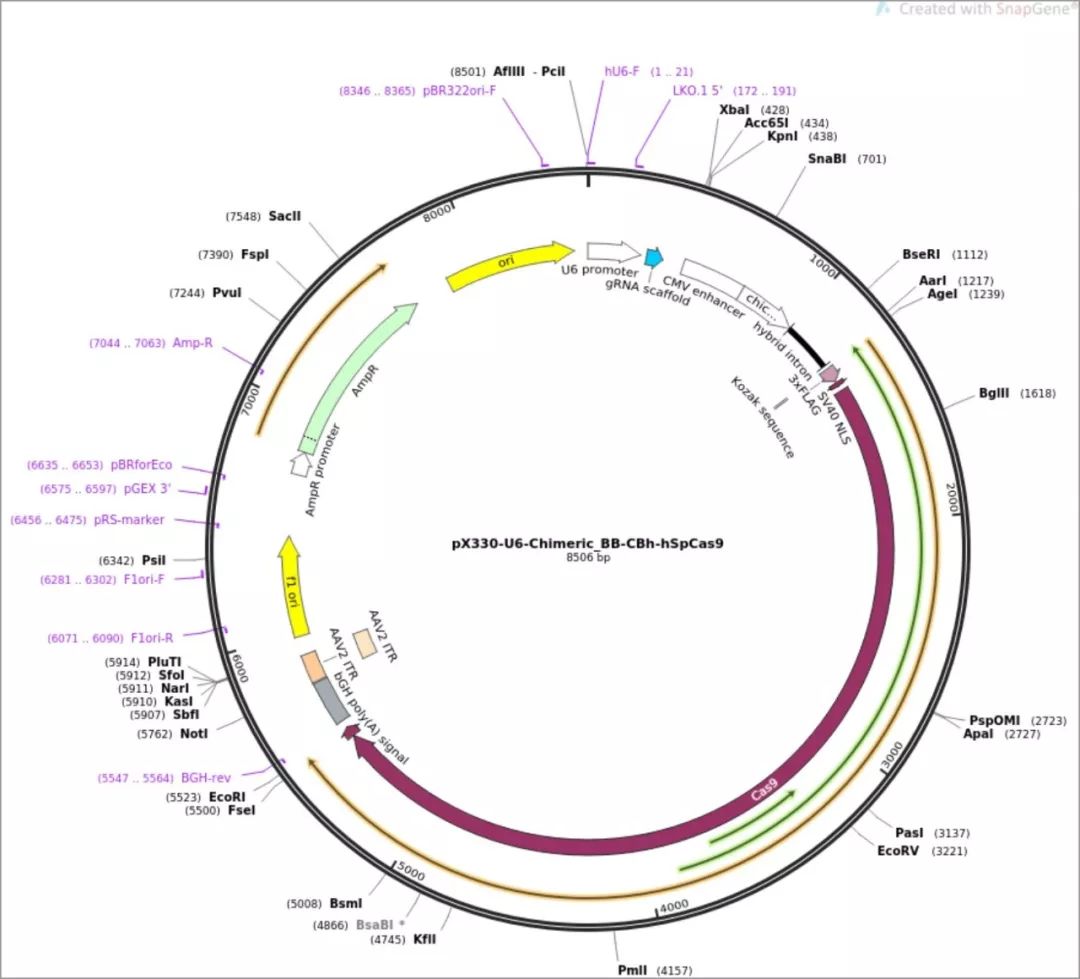
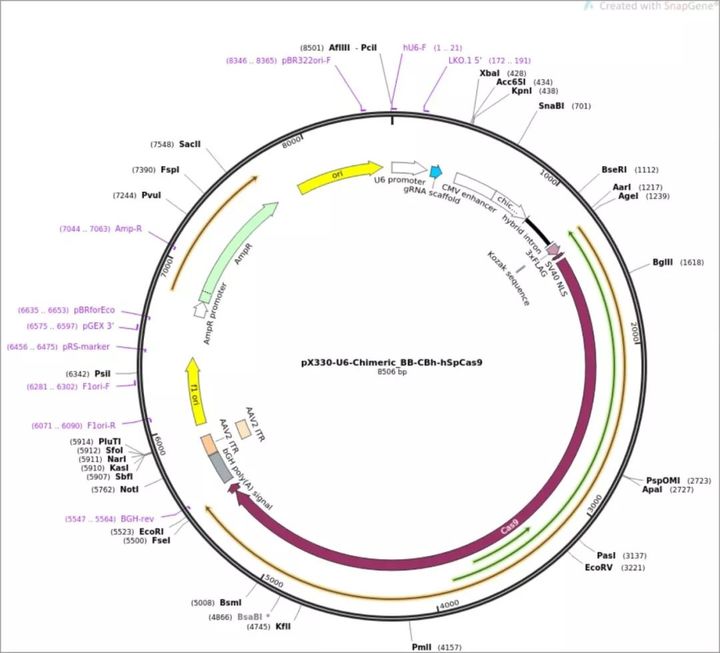
作者使用了张锋共享到Addgene的Cas9质粒:px330,质粒图谱如下:
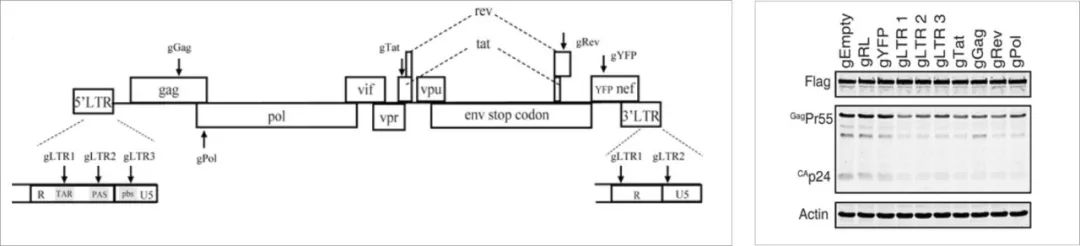
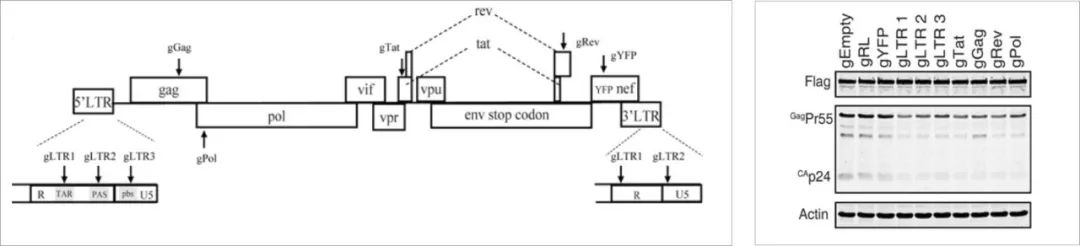
1、通过Cas9 / gRNA抑制HIV-1复制
首先设计了靶向HIV-1的LTR、gag、pol、tat和rev区的sgRNA(下图左),实验结果表明靶向LTR和tat基因的sgRNA比其他实验组的sgRNA更强烈地抑制HIV-1感染(下图右)。
2、Cas9 / gRNA抑制HIV-1的产物
在存在Cas9/gRNA的情况下,HIV-1病毒的各种蛋白产物大大降低,这些结果进一步证实CRISPR / Cas9能够通过突变病毒DNA来抑制HIV-1感染。
3、CRISPR / Cas9抑制HIV-1逆转录和整合
HIV-1感染后,病毒核进入细胞,逆转录形成线性病毒DNA,并将病毒DNA整合到细胞染色体中。 除了导致病毒DNA的插入和缺失来灭活HIV-1外,CRISPR / Cas9还可能在HIV-1感染期间减少其DNA的水平,因为Cas9切割的HIV-1 DNA如果不立即修复, 会发生降解。 这也是CRISPR / Cas9除了切割HIV-1 DNA之后的NHEJ修复之外导致HIV-1 DNA降低的另一种机制。
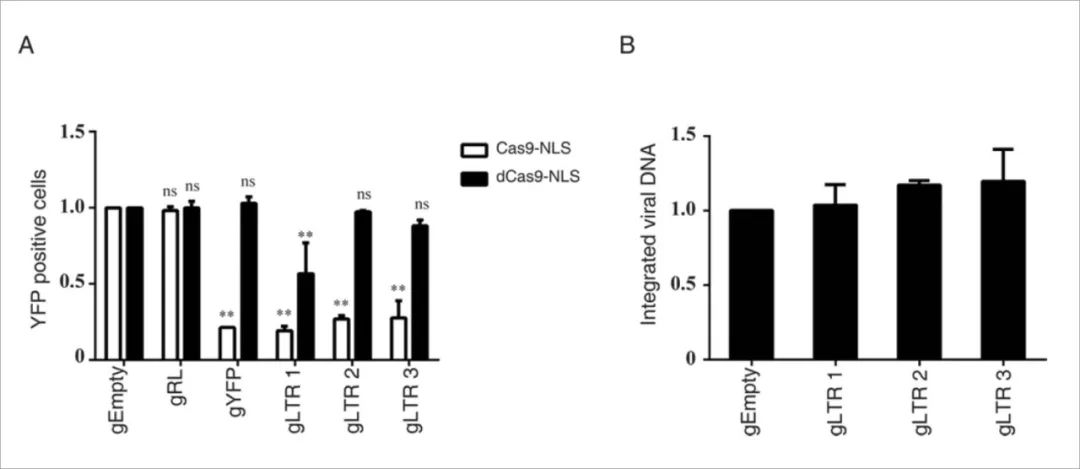
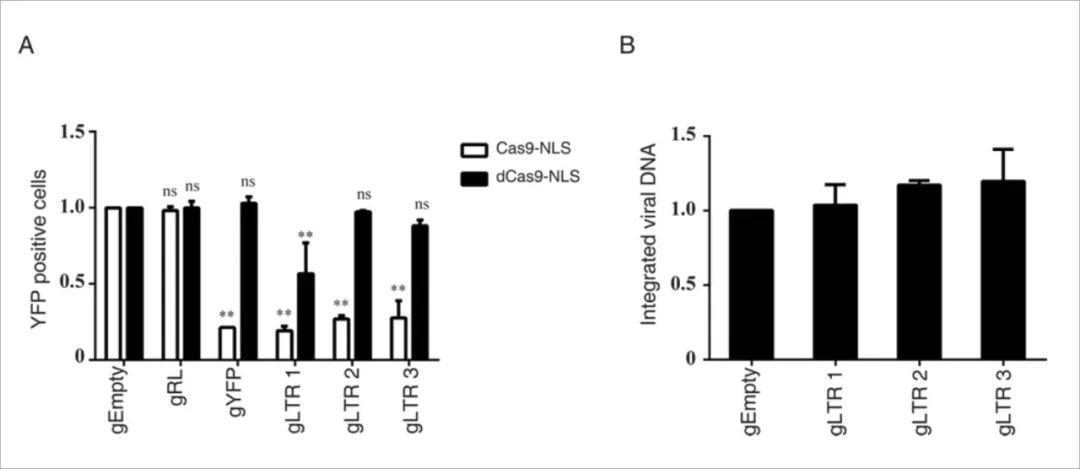
4、Cas9需要核酸酶活性来抑制HIV-1感染
Cas9含有两个核酸酶结构域HNH和RuvC,它们是Cas9切割两条DNA链所必需的,接下来测试了非切割活性的Cas9-NLS(dCas9-NLS,D10A和H840A)对HIV-1的抑制能力。结果显示,当与HIV-1特异性gRNA共同作用时,dCas9-NLS不会抑制HIV-1感染,除了gLTR1靶向HIV-1 tat响应性茎环结构(TAR)并适度减少HIV-1感染。这可能是dCas9 / gLTR1与转录起始位点结合并阻断RNA聚合酶启动转录的结果。进一步实验表明整合病毒的DNA的水平在表达dCas9-NLS / gRNA的细胞中不受影响。这些结果表明核酸酶活性对于Cas9抑制HIV-1感染至关重要。
5、CRISPR / Cas9能够编辑和灭活细胞质中的HIV-1 DNA
由于HIV-1逆转录发生在细胞质中,因此检测了没有NLS的Cas9(Cas9-delNLS)不位于细胞核内,是否也能够裂解细胞质中新合成的HIV-1 DNA,从而抑制HIV-1感染。
注:NLS,核定位序列(Nuclear localization sequence)——蛋白质的一个结构域,通常为一短的氨基酸序列,它能与入核载体相互作用,使蛋白能被运进细胞核。缺失NLS序列的蛋白质无法进入细胞核。
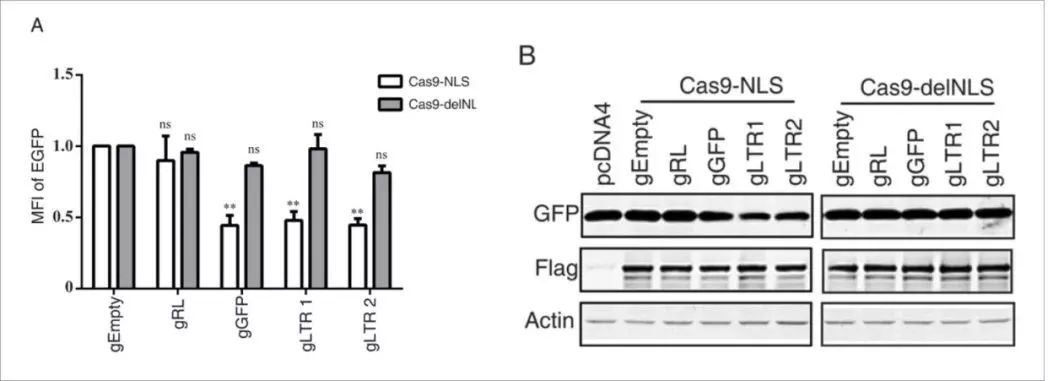
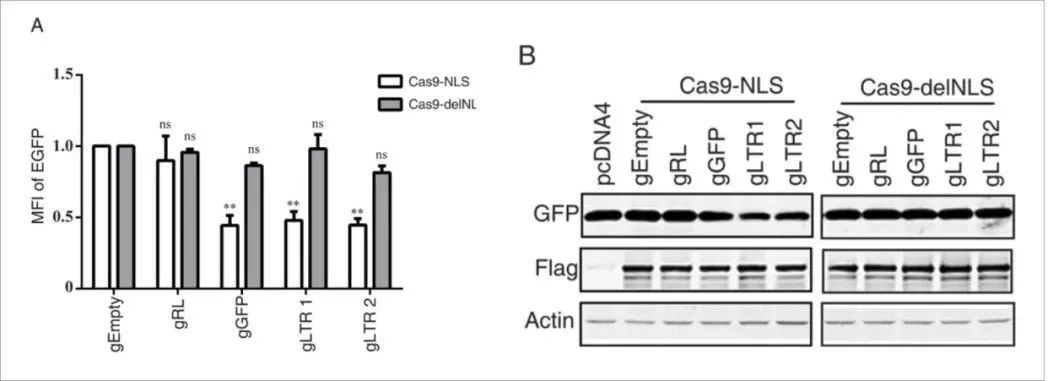
免疫荧光成像实验的结果显示Cas9 delNLS严格位于细胞质中,而不是像Cas9 NLS在细胞质和细胞核中均有分布(下图)。
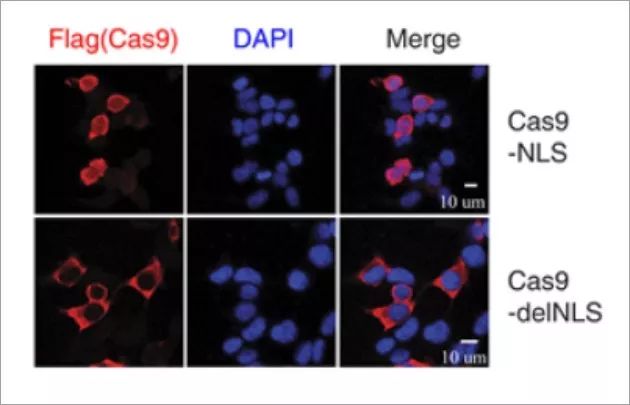

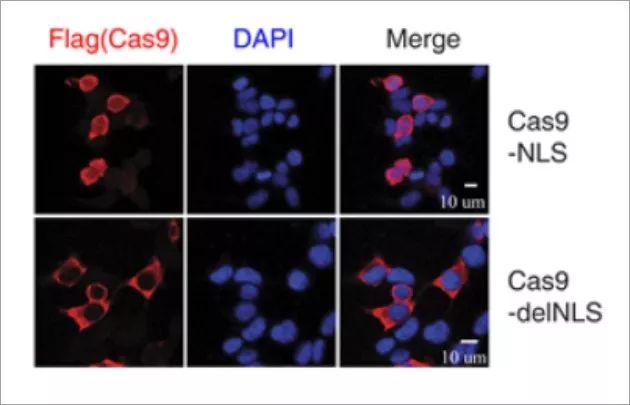
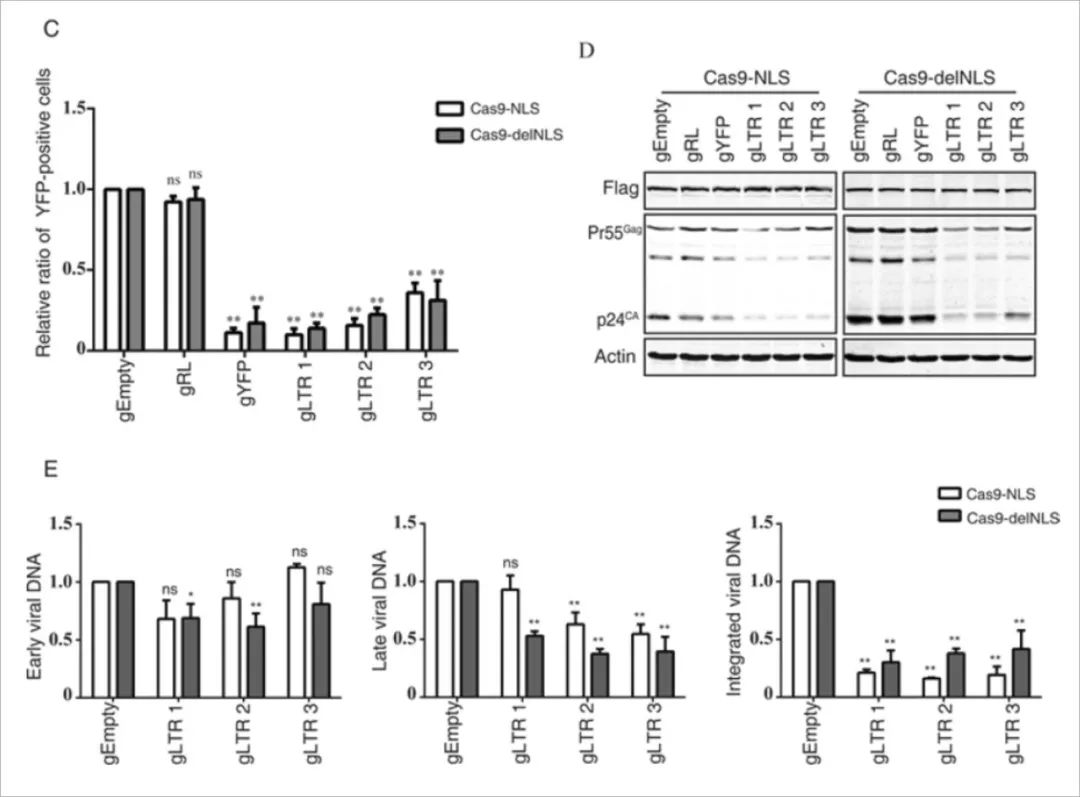
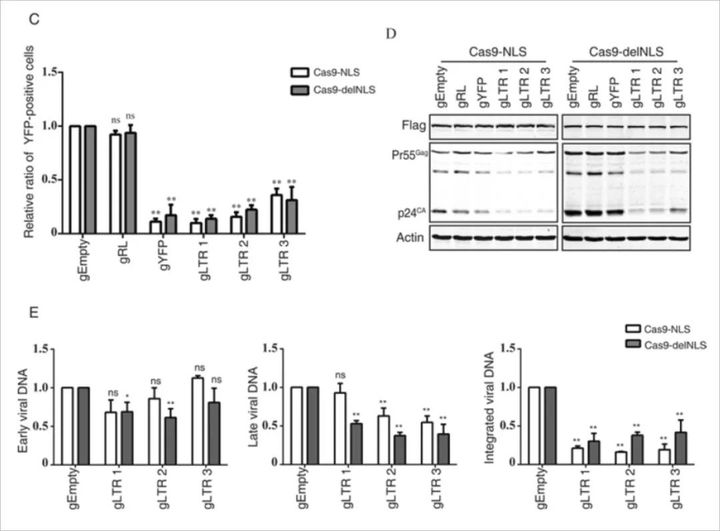
Cas9-delNLS / gRNA抑制HIV-1基因表达的程度与Cas9-NLS / gRNA类似,此外,rt-PCR结果显示,Cas9-delNLS / gRNA和Cas9-NLS / gRNA都降低了晚期病毒DNA和整合病毒DNA的水平。 此外,Cas9-delNLS / gRNA将晚期病毒DNA和整合病毒DNA的水平降低至相似水平,表明原病毒DNA的减少是晚期病毒DNA减少的结果。 然而,整合的病毒DNA水平低于由Cas9-NLS / gRNA编辑的晚期病毒DNA的水平。 另外,Cas9-delNLS / gRNA适度降低了早期病毒DNA产物的水平。这些数据表明Cas9-delNLS能够通过切割和降解细胞质中的HIV-1 DNA来抑制HIV-1感染。
注:病毒复制过程中,mRNA可分为:早期,次早期,晚期.主要区别在于转录翻译的蛋白质不同。
为了进一步证明Cas9-delNLS仅在细胞质中而不是在细胞核中切割HIV-1DNA,在293LTR-GFP细胞中进行实验,所述细胞带有受HIV-1LTR启动子控制的GFP DNA。 HIV-1 LTR和GFP DNA被整合到细胞DNA中hiv病毒,因此仅存在于细胞核中。当我们用Cas9-delNLS / gRNA或Cas9-NLS / gRNA转染该LTR-GFP细胞,并通过流式细胞术检测GFP表达时,发现只有用Cas9NLS / gRNA的显著减少GFP表达,而不是Cas9-delNLS / gRNA。