造血干细胞移植治疗白血病技术已日益成熟,然而,通过该方法同时治愈艾滋病目前还是一道全球尚在攻克的难题。
艾滋病被发现的40年时间里,10年前的“柏林病人”和今年3月被报道的“伦敦病人”分别实现了“功能性治愈”和“持续缓解、需继续观察”。他们的主治医师均采用了一套类似的“一石二鸟”的方:HIV-1患者在CCR5Δ32/Δ32造血干细胞移植后病情处于长期缓解,既让他们白血病不再复发,又彻底治愈了艾滋病。
9月11日,北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组合作在顶级医学杂志《新英格兰医学杂志》(The New England Journal of Medicine)发表了题为《利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建》(CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia)的研究论文,建立了基于CRISPR在人成体造血干细胞上进行CCR5基因编辑的技术体系治愈艾滋病,实现了经基因编辑后的成体造血干细胞在人体内长期稳定的造血系统重建。
区别于此前两例病人直接移植“天然”CCR5Δ32/Δ32造血干细胞,邓宏魁等人合作成立的研究团队在全球范围内报道了首例利用第三代基因编辑技术CRISPR-Cas9在HSPCs(造血干细胞和祖细胞)中编辑CCR5基因并成功移植到一名同时患有HIV和急性淋巴细胞白血病的27岁男性患者案例。
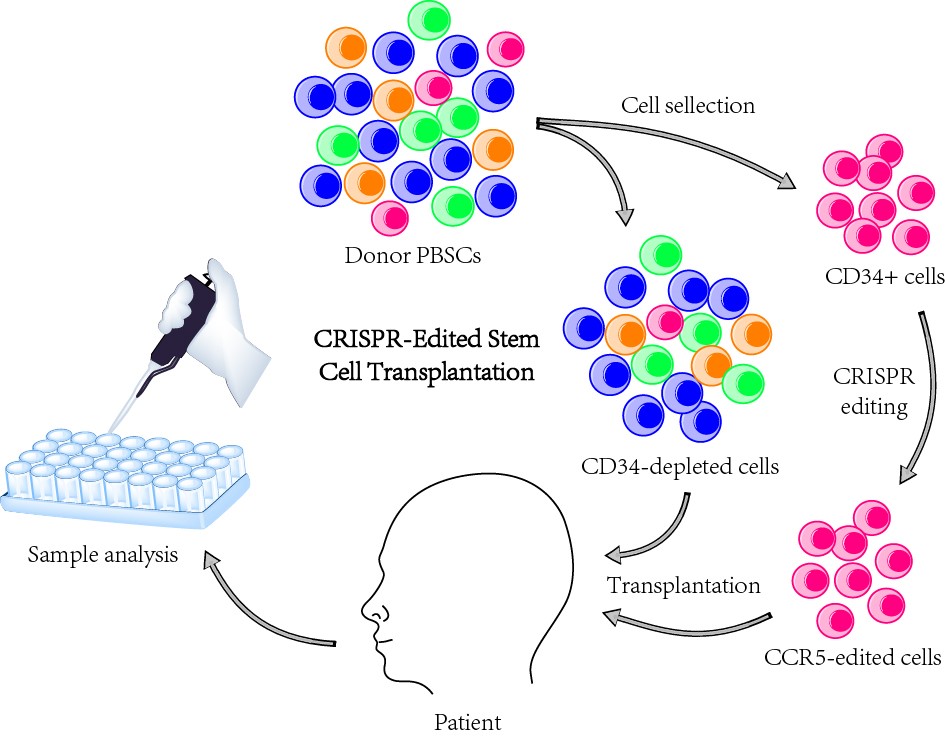
基因编辑的造血干细胞移植流程图。
研究结果显示,基因编辑后的造血干细胞移植治疗使患者的急性淋巴白血病得到完全缓解,携带CCR5突变的供体细胞能够在受体体内长期存活已达19个月,初步探索了该方法的可行性和安全性。
北京大学官网报道对此研究表示,在成体造血干细胞上的基因编辑并不会对其他组织器官及生殖系统产生影响。该工作初步证明了基因编辑的成体造血干细胞移植的可行性和在人体内的安全性,将会促进和推动基因编辑技术在临床应用领域的发展。
HIV病毒之所以能够摧毁人体的免疫力,因为它能感染免疫系统中十分重要的CD4+T淋巴细胞。绝大多数HIV入侵免疫细胞的过程中,需要借助CD4+T淋巴细胞表面的两种“路标”蛋白来引路,一种是CD4,另一种就是CCR5。也有少数HIV入侵需要的第二种蛋白是CXCR4而非CCR5。
而目前有大概1%的白人天生对艾滋病免疫。此前的研究在他们身上发现,编码CCR5蛋白的基因出现了功能突变,对多数HIV来说也就失去了“路标”作用。
值得一提的是,HIV入侵T细胞的主要共受体CCR5于1996年被发现,这认为是艾滋病领域的里程碑式进展,邓宏魁即是主要发现者之一。
在此番这项最新研究中,27岁的男性患者于2016年5月被相继诊断出患有艾滋病和急性淋巴细胞白血病。经过1年的艾滋病抗逆转录病毒治疗后,邓宏魁、陈虎等人带领的研究团队将CCR5敲除后的供者来源的CD34+成体造血干细胞回输到患有白血病合并艾滋病的患者体内,进行了长达两年的移植重建及基因编辑效果的评价。
研究结果显示,在供者来源的CD34+细胞上实现了17.8%的CCR5基因敲除效率;移植后4周,患者白血病处于完全缓解状态,供者型骨髓细胞嵌合率达100%;经过长达19个月的随访发现,患者白血病处于持续完全缓解状态,供者型细胞完全嵌合,骨髓细胞中能够持续检测到CCR5基因编辑。
另外,为初步探索治疗的有效性,研究团队对该患者短暂停止服用抗HIV病毒药物。在短暂停药期间,CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力;19个月的观察中也并未发现基因编辑造成的脱靶及其他副作用。
研究团队表示,这些结果表明,基于CRISPR的成体造血干细胞基因编辑技术能够在患者体内实现长期稳定的基因编辑效果,经过编辑后的成体造血干细胞能够长期重建人的造血系统。
不过,值得注意的是,就目前的论文数据而言,研究团队仅称“在短暂停药期间,CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力”。
清华大学医学院教授、艾滋病综合研究中心主任张琳琦点评表示,对于艾滋病的治疗效果与未经过基因治疗患者相比差别不大,主要反应在短暂的停药期间,病毒反弹和CD4+T细胞下降等方面。这种现象的发生,很有可能是移植的成体造血干细胞本身是CCR5基因野生型和敲除的混合体,其中带有野生型CCR5基因的CD4+T细胞,为病毒的复制和反弹提供了场所。
张琳琦认为,这突显提高基因编辑效率的重要性。此外,如何在成体造血干细胞基因编辑和移植之前,清除患者体内的艾滋病病毒,防止嵌合免疫重建细胞感染,阻止病毒复制和反弹,同样是提高治疗效果的关键。
实际上,如何在造血干细胞中进行高效基因编辑一直是实现临床应用的关键瓶颈。
2017年,邓宏魁研究组已建立了利用CRISPR/Cas9进行人造血干细胞基因编辑的技术体系。经过基因编辑后的人造血干细胞在动物模型中长期稳定地重建人的造血系统,其产生的外周血细胞具有抵御HIV感染的能力,该研究成果发表在《Molecular Therapy》杂志。
为了实现该技术在此番临床上的应用治愈艾滋病,邓宏魁等人在上述基础上又进行了一系列的优化。
研究团队认为,在今后的研究中,将进一步提高基因编辑效率及优化移植方案,有望加速基因编辑造血干细胞移植技术向临床疾病治疗转化进程。
另外,令人遗憾的是,作为全国造血干细胞移植领域的领军人物,也就是本次论文的通讯作者之一、全军造血干细胞移植中心主任、血液病专业委员会副主任、国家科技进步一等奖获得者、中国科学院院士候选人、解放军总医院第五医学中心(原307医院)教授陈虎,已于2019年7月24日因病逝世,享年57岁。而攻克艾滋病正是陈虎的一大未完成的遗愿。
/uploads/",@me) /}