艾滋病(AIDS),又称获得性免疫缺陷综合征,是由于感染艾滋病病毒(HIV),进而攻击人体免疫系统的恶性传染病,HIV以机体免疫系统中的CD4+T淋巴细胞作为主要攻击目标,使机体逐渐丧失免疫功能治愈艾滋病,导致机体抗感染的能力降低甚至丧失。AIDS的治疗,目前主要采用病毒转录抑制药,但这种病毒转录抑制药并不能彻底治愈AIDS,患者需终身服药,且HIV在体内变异速度极快,随着抗逆转录病毒药物种类使用的增加,HIV的耐药性也在不断上升。造血干细胞移植疗法在AIDS治疗方面表现突出,为AIDS患者及医学界带来了希望。
国际临床研究
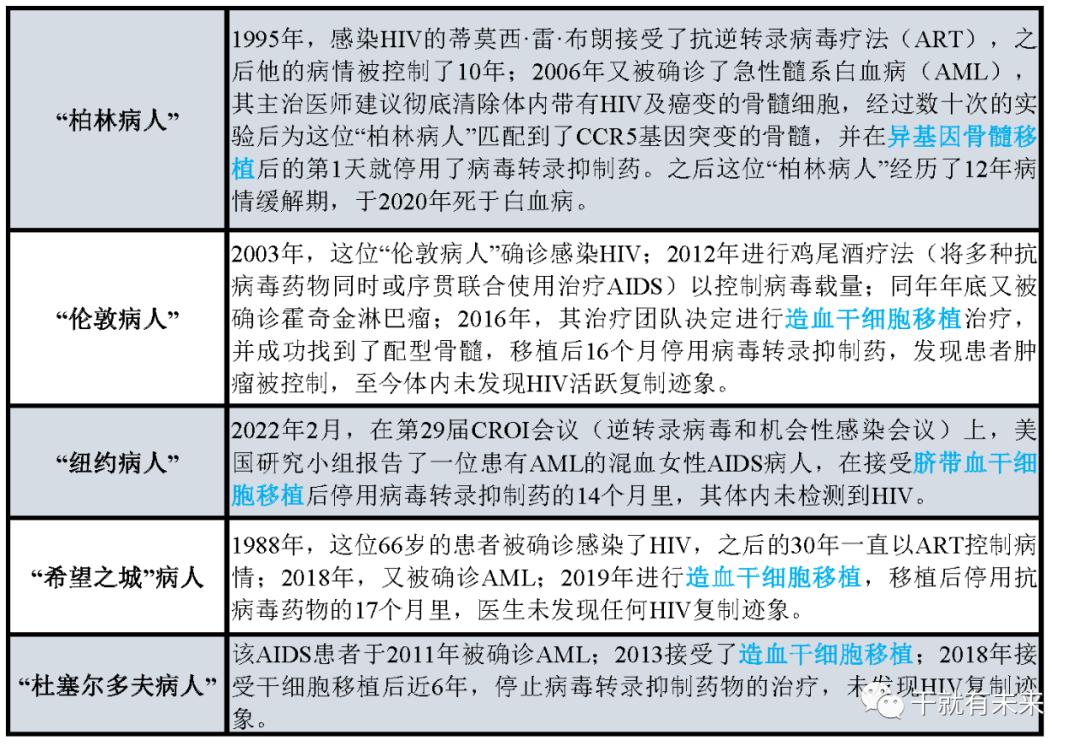
AIDS患者需要移植CCR5基因突变的造血干细胞,但CCR5基因突变的人群极少,多为北欧后裔,这种基因突变使得他们对HIV具有抵抗力,全球只有不到1%的人携带了这种基因。而抗逆转录病毒治疗过程中病人需要承受巨大的痛苦治愈艾滋病,且这种治疗方法并不能成为治愈所有患者方法。这些临床先例,无疑让干细胞在AIDS中的治疗提供更多思路和可能性,有望开创治疗AIDS的新大门。
国内临床研究
2019年
王福生院士团队设计了针对HIV-1免疫无应答者(INR)患者的hUC-MSC输注的多中心、随机、双盲、安慰剂对照、剂量确定的II期临床试验,研究以高(1.5×106/kg体重)、低剂量(0.5×106/kg体重)hUC-MSC,或安慰剂进行分配,96周后随访检测临床免疫参数。在整个治疗过程中未发现不良反应,在高剂量组中也未观察到细胞因子释放综合征(一种因免疫细胞被激活并释放大量细胞因子而引发的严重全身炎症反应综合征),研究证明MSC对治疗HIV-1的INR患者的耐受性良好,部分改善了患者的宿主免疫重建。()
2021年
北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员利用CRISPR基因编辑的成体造血干细胞在患有AIDS合并急性淋巴细胞白血病患者中长期重建。研究中一名27岁男性于2016年被诊断为HIV-AIDS(获得性免疫缺陷综合征)和急性淋巴细胞白血病(T细胞型)。将CRISPR编辑的CCR5敲除造血干细胞和祖细胞移植到患者体内,并对患者进行了19个月的随访,发现骨髓移植后淋巴细胞和T细胞亚群数量明显上升,CD4+细胞数在移植后6个月达到正常范围,并在之后随访阶段一直维持正常水平,且随访期间患者未出现与CCR5编辑相关的副反应,未观察到该基因编辑具有脱靶效应。该研究建立了基于CRISPR在人成体造血干细胞上进行CCR5基因编辑的技术体系,实现了经基因编辑后的成体造血干细胞在人体内长期稳定的造血系统重建。()
干细胞是一类具有多向分化潜能的细胞群,在免疫调控、重建机体免疫系统,恢复、替代受损细胞和组织等方面具有重要作用。干细胞可分化为T细胞、巨噬细胞等免疫细胞,增强机体免疫系统,提高机体免疫力及抗病毒能力,降低机体被其它病毒感染的风险。研究中基因编辑造血干细胞的可行性与安全性,势必将促进和推动该技术的临床应用。但异体造血干细胞移植仍是一种高风险疗法,目前仅适用于一些同时患有HIV-1及血液癌症的患者,这些结果或能为未来实现长期缓解HIV-1提供新思路,愿新技术、新疗法、新科技真正造福人类。
《医学参考报》干细胞与再生医学专刊
由同济大学附属东方医院承办
感谢大家的支持!
/uploads/",@me) /}